Mécanisme de changement de liaisons (Modèle de P.Boyer)
Les nucléotides adényliques[1] ADP et ATP ne se fixent aux sous-unités β qu'en présence de Mg2+. Dans ce mécanisme, les trois sites catalytiques du CF1 changent de conformation de manière séquentielle, chacune des conformations étant caractérisée par une constantes d'affinité différente pour les nucléotides (Fig. 37). Les trois conformations sont :
la conformation "ouverte", notée O pour "Open" dans la littérature anglo-saxonne. C'est une conformation dans laquelle la libération de l'ATP et l'entrée de nouvelles molécules de substrat sont favorisées,
la conformation "relâchée" dans laquelle le site catalytique a une faible affinité pour les nucléotides. Dans la littérature anglo-saxonne, elle est notée L pour "Loose". Dans cette configuration, la liaison des substrats au site catalytique se déroule,
la conformation "fermée", dans laquelle le site catalytique a une forte affinité pour les nucléotides. Cette configuration est notée T pour "Tight") dans la littérature anglo-saxonne. C'est dans cette configuration que la catalyse enzymatique a lieu.
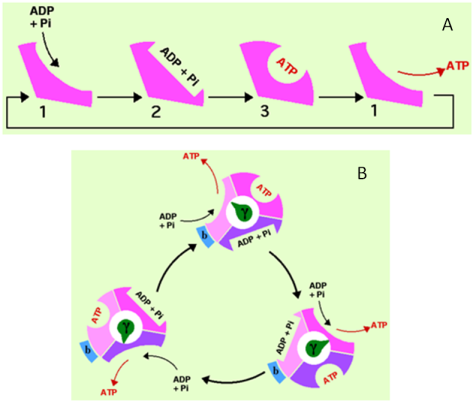
A. Les changements de conformation du site catalytique lors du fonctionnement de l'ATP synthase.
Ce schéma présente la succession des trois conformations des sites catalytiques portés par les sous-unités du CF1. Dans ce modèle, une seule de trois sous-unités β est représentée. Lorsque le site catalytique est dans sa conformation
(ouvert), la libération de l'ATP formé et l'entrée de nouvelles molécules d'ADP et Pi se déroulent
(relâchée), la liaison des substrats ADP et Pi au site catalytique a lieu
(fermé), la formation de l'ATP se déroule
B. Les trois sites catalytiques ne sont pas dans le même état au même moment
Lorsque l'axe central du CF1 - la sous-unité ϒ - tourne, elle induit le changement séquentiel de conformation des sous-unités β. En conséquence, les 3 sous-unités catalytiques sont dans un état différent au même moment.
Il est proposé que la forme irrégulière de l'axe central du CF1 correspondant à la sous-unité ϒ qui est solidaire des sous-unités c du CF0, induit, en tournant de 120°, le changement séquentiel de conformation des sous-unités β. En conséquence, à chaque rotation, une molécule d'ATP est libérée. Donc, au même moment, les 3 sous-unités catalytiques sont dans un état différent (Figure 37B).