Le schéma en Z
Nous avons appris ci-dessus qu'une fois l'électron arraché à la molécule du P680, il est transféré de transporteur en transporteur jusqu'à aboutir à la formation du NADPH. La présence d'un ou plusieurs électrons supplémentaires sur un transporteur modifie l'état d'oxydoréduction du transporteur. La valeur de ce potentiel est caractéristique du transporteur (Tableau 1.2.2.13.T1). L'examen attentif des potentiels rédox présentés dans le tableau montre que le potentiel qui correspond à l'oxydation de l'eau (H2O → O2) est très important avec un potentiel rédox de + 0.82 V tandis que celui de Fx est très faible (- 0.73 V). Comme vous le constaterez en étudiant le tableau 1.2.2.13.T1, les potentiels rédox des transporteurs participant au processus photosynthétique se trouvent dans cette fourchette.
Comme vous l'avez appris pendant vos cours de chimie, les réactions d'oxydoréduction se déroulent spontanément lorsque l'on passe d'un potentiel d'oxydoréduction vers un autre plus faible. L'organisation des transporteurs d'électrons, rangés en accord avec leur potentiel d'oxydoréduction forment la lettre Z qui a donné son nom à ce type de diagramme : le schéma en Z (Figure 32). Or, le transfert d'un électrons vers la phéophytine à l'aide d'un électron provenant de l'eau nécessite un apport d'énergie équivalent à 1,5 V. L'énergie nécessaire provient des photons capturés par l'antenne et dont l'énergie est transférée aux centres réactionnels. L'énergie associée à l'électron sera progressivement dissipée au cours des différentes réactions d'oxydoréduction impliquées dans chaque transfert. Lorsque les électrons sont pris en charge par la plastocyanine, l'énergie associée n'est plus suffisante pour permettre la réduction du NADP+. Il est donc nécessaire d'associer plus d'énergie à ces électrons. C'est le rôle du photosystème I.
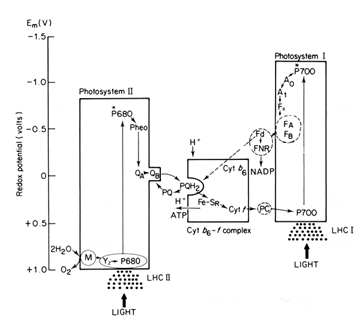
Le potentiel d'oxydoréduction de chaque transporteur est indiqué sur l'axe Y. Les réactions d'oxydoréduction se déroulent spontanément lorsque l'on passe d'un potentiel d'oxydoréduction positif vers un potentiel plus petit. Par exemple, le transfert d'un électron du P680 vers la phéophytine nécessite un apport d'énergie équivalent à 1,5 V. Cette énergie provient des photons capturés par l'antenne et dont l'énergie est transférée aux centres réactionnels. L'énergie associée à l'électron est progressivement dissipée au cours des différentes réactions d'oxydoréduction impliquées dans chaque transfert. Lorsque les électrons sont pris en charge par la plastocyanine, l'énergie associée n'est plus suffisante que pour permettre la réduction du NADP+. Il est donc nécessaire d'associer plus d'énergie à ces électrons.