Le photosystème I
En première approximation, le photosystème I présente une organisation semblable à celle du photosystème II avec un centre réactionnel composé d'un dimère de protéines (PSI-A et PSI-B dans la figure 30). Ce sont de grosses protéines d'environ 80 kD. Au coeur du complexe est logé la paire spéciale de molécules de chlorophylle a dont nous avons parlé précédemment. Elle est appelée P700 en référence à la valeur du 2ème maximum dans le spectre d'action de la photosynthèse mesuré par Emerson. Le centre réactionnel du PSI contient plusieurs cofacteurs permettant le transport d'électrons provenant de l'ionisation d'une des molécules de chlorophylle du P700 : A0 est une molécule de chlorophylle a, A1 est une phylloquinone tandis que FX est un centre “fer-soufre” du type [4Fe-4S]. Ces centres sont aussi appelés “centres de Rieske”, du nom du scientifique qui les a découverts (Rieske et al. 1964) (Figure 30). Les complexes protéines-pigments LHCI forment l'antenne collectrice de l'énergie lumineuse. La dénomination LHC signifie Light Harvesting Complex ou Complexe collecteur de la lumière (Figure 30). Le photosystème I contient d'autres protéines telles que le polypeptide PSI-I et PSI-J qui remplissent des rôles structuraux. Leur description sort du cadre de cette ressource. Comme l'illustre la figure 30, cet assemblage de protéines est disposé dans la membrane photosynthétique. Pour la compréhension du mécanisme, il est important de comprendre l'orientation des composants du photosystème I à savoir que le P700 est situé du côté exposé au stroma et que les électrons arrachés à la molécule de chlorophylle du P700 sont acheminés par transfert vers PSI-C, une protéine exposée au stroma du chloroplaste et contenant deux centres de Rieske, notés FA et FB (Figure 30).
Du point de vue fonctionnel, l'énergie absorbée par l'antenne collectrice de l'énergie lumineuse arrive au niveau du P700 (Figure 30) et provoque l'ionisation d'une des molécules de chlorophylle de ce dernier. Le P700 est relié électroniquement à la molécule de chlorophylle A0 (Figure 30). Dans la figure 30, les transferts d'électrons sont représentés par les flèches noires. Le transfert d'électrons vers A1, FX, FA et FB aboutit à la ferrédoxine (Fd) une protéine qui contient deux centres “fer-soufre” de type 2Fe-2S. Comme vous le constater sur la figure, la ferrédoxine est amarrée au photosystème I au niveau des deux protéines de structure PSI-D et PSI-E (Figure 30). Dans la langue anglaise, ces protéines sont désignées par le terme “docking proteins”. La traduction n'est pas simple mais nous pourrions les appeler protéines d'amarrage. Ceci suggère que la ferrédoxine est une protéine mobile. C'est en effet le cas, la ferrédoxine apportant les électrons à la ferrédoxine: NADP+ réductase qui assure la réduction du NADP+ en NADPH. Nous reviendrons sur cet aspect un peu plus tard.
Il existe une autre protéine d'amarrage dans le photosystème I. Il s'agit de la protéine PSI-F, exposée à la lumière des membranes photosynthétiques (lumen). Le rôle de cette protéine est de permettre l'ancrage de la plastocyanine (PC dans la Figure 30). Cette petite protéine de 10,5 kD contient un atome de cuivre. Elle achemine les électrons en provenance du photosystème II.
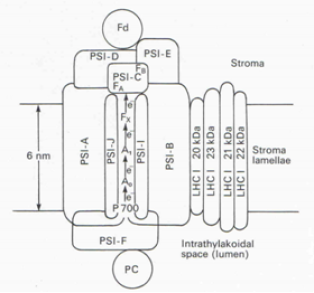
L'énergie absorbée par l'antenne collectrice de l'énergie lumineuse (LHCI) arrive au niveau du P700 et permet l'extraction d'un électron au P700. Il est transféré à la ferrédoxine (Fd) grâce aux transporteurs fixes A0, A1, FX, FA et FB. La ferrédoxine est amarrée au photosystème I au niveau des deux protéines de structure PSI-D et PSI-E. La ferrédoxine est la protéine mobile apportant des électrons à la ferrédoxine: NADP+ réductase qui les utilise pour réduire du NADP+ en NADPH. Le vide électronique créé au niveau du P700 est comblé par l'apport d'un électron en provenance du photosystème Il. Il est transporté par la plastocyanine. Cette dernière s'arrime à la protéine PSI-F.