Les expériences fondatrices : Pelletier, Caventou et Englemann
A l'époque des découvertes de PRIESTLEY et INGENHOUSZ (Figure 7), le composé responsable de la couleur verte des feuilles était inconnu et de nombreuses théories - qu'il faut regarder aujourd'hui comme farfelues - avaient cours. Ce sont les chimistes et pharmaciens Pierre Joseph PELLETIER (1788-1842) et Joseph Bienaimé CAVENTOU (1795-1877) (Figure 7D et E) qui, en 1817, les premiers ont isolé et caractérisé les pigments verts des feuilles. Ils appellent cette nouvelle molécule la chlorophylle. Ce terme prend ses racines dans le grec ancien χλωρός/khlôrós (« vert ») et φύλλον/phúllon (« feuille »). Il est rapidement reconnu que la chlorophylle n'occupe que des volumes limités dans la cellule photosynthétique. Ces volumes sont le plus souvent désignés par le terme de “grains” car sous le microscope, ils apparaissent ainsi. Dans de rares cas, la chlorophylle prend une autre forme. Le ruban en forme de spirale de la microalgue d'eau douce Spirogyra est un bon exemple (Fig. 11). Si les propriétés chimiques de la chlorophylle restaient encore inconnues à cette époque, on pouvait se demander comment cette molécule participait au phénomène photosynthétique. C'est un professeur allemand, Theodor Wilhelm ENGELMANN (1843-1909) qui en fit une première démonstration en 1881-1882 (Figure 7F). Pour bien évaluer le génie d'ENGELMANN et la portée de ses travaux, il faut essayer de s'immerger dans les conditions expérimentales de l'époque :
l'instrument scientifique le plus courant à cette époque est le microscope. Il n'est pas équipé d'une ampoule électrique, qui vient cependant d'être inventée par Thomas EDISSON en 1879. La seule source de lumière disponible pour les observations est donc la lumière solaire qu'il faut diriger sur l'échantillon à l'aide d'un miroir. Il y a donc peu de contrôle sur la quantité de ce paramètre.
les microméthodes qui permettent aujourd'hui de mesurer la concentration en oxygène d'une solution ne sont pas connues, seules des méthodes macroscopiques sont envisageables; ces dernières nécessitent l'accumulation de grandes quantités de gaz, ce qui représente un danger lorsqu'il s'agit de l'oxygène.
Pour arriver à ses fins, Engelmann choisit :
une microalgue particulière : Spirogyra sp. (Fig. 11). Cette algue verte présente la particularité de disposer d'un chloroplaste en forme de ruban formant une spirale(voir encart). L'organisation spatiale particulière du chloroplaste permet à Engelmann de tester l'effet de la lumière sur les parties contenant de la chlorophylle et sur les parties n'en contenant pas, sans changer d'échantillon.
une méthode originale de mesure de l'oxygène : pour localiser de manière précise les zones de la microalgue impliquées dans la photosynthèse, il ajoute à la préparation la bactérie Bacterium thermo doué d'un chimiotactisme positif[1] pour l'oxygène. L'abondance relative des bactéries donne une indication, certes qualitative, sur l'intensité de l'émission de l'oxygène.
un système d'illumination précis : afin d'optimiser l'utilisation du matériel biologique choisi, il demande à Carl ZEISS d'imaginer un dispositif de décomposition permettant d'illuminer la préparation avec une composante de la lumière solaire au travers de l'objectif (Figure 12). Il dispose ainsi d'un microscope muni d'un microspectrophotomètre lui permettant d'illuminer des surfaces très petites de la préparation (Figure 13). Le microscope dont ENGELMANN dispose est donc équipé de deux systèmes d'illumination. Le premier permet une illumination complète de l'échantillon par la lumière solaire au travers du condensateur. Lorsque ce système n'est pas utilisé, l'échantillon apparaît sur un fond noir. Le second système est indépendant du premier. Il permet l'illumination d'une zone restreinte de l'échantillon au travers de l'objectif du microscope par une lumière monochromatique.
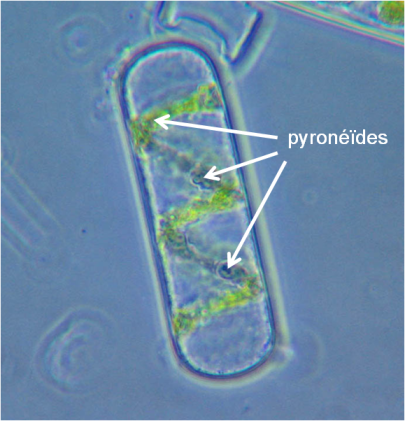
Frédéric Marbach. Une cellule de spirogyre montrant un chloroplaste rubané enroulé en spirale et portant des pyrénoïdes. 2006. disponible sous licence CC BY-SA 3.0. Disponible sur : https://fr.wikipedia.org/wiki/Spirogyre#/media/File:Spirogyra_cell.jpg

Le boitier “A'” contient un prisme permettant la décomposition de la lumière blanche entrant par l'ouverture “d'”. La molette permet de déplacer le prisme de telle sorte à orienter les rayons de la couleur choisie vers le tube sous-jacent. Les oculaires “L” et “n” permettent de contrôler l'orientation du faisceau de lumière colorée.
Afin de vérifier que le dispositif expérimental qu'il a mis au point fonctionne selon ses attentes, Engelmann illumine d'abord l'ensemble de l'échantillon avec de la lumière blanche (Fig. 13A). Il observe alors les bactéries se disposant autour du ruban vert. L'appareillage préparé répond donc bien aux attentes formulées à savoir le chimiotactisme positif des bactéries pour l'oxygène. Il place ensuite l'échantillon sur un fond noir et illumine successivement deux endroits de la préparation et observe la réaction des bactéries. Lorsqu'il illumine le ruban vert, les bactéries s'amoncellent sur l'endroit illuminé alors que lorsqu'il choisit une zone entre deux tours d'hélice, aucun mouvement particulier de bactéries n'est observé (Fig. 13B). Il vérifie ainsi les conclusions d'INGENHOUSZ concernant la capacité des parties vertes d'émettre de l'oxygène et les généralise aux microorganismes. Engelmann teste ensuite l'effet des rayonnements monochromatiques (rouge ou vert) et découvre que l'émission d'oxygène est très importante lorsque le ruban vert est illuminé par de la lumière rouge et presque absent lorsqu'il est illuminé par de la lumière verte (Fig. 13C), établissant pour la première fois un spectre d'action de la photosynthèse. Il découvre également une propriété importante des chlorophylles à savoir leur capacité à absorber les rayonnements rouges.
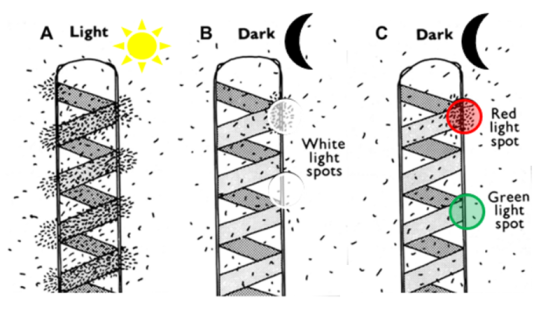
A. L'échantillon est illuminé par de la lumière blanche : les bactéries se disposent autour du ruban vert. L'appareillage préparé répond donc bien aux attentes formulées à savoir le chimiotactisme positif des bactéries pour l'oxygène.
B. L'échantillon est placé sur fond noir et illuminé par un faisceau de lumière solaire au travers de l'objectif. Lorsque le ruban vert est irradié, les bactéries s'amoncellent à l'endroit illuminé. Lorsqu'une zone entre deux tours d'hélice est irradiée, aucun mouvement de bactéries n'est observé.
C. L'échantillon est placé sur fond noir et illuminé par un faisceau de lumière monochromatique (rouge ou vert). Lorsque le ruban vert est illuminé par de la lumière rouge, les bactéries s'amoncellent alors que lorsqu'il est illuminé avec de la lumière verte, il n'y pas de mouvement des bactéries.
Aujourd'hui, les méthodes quantitatives de mesure du dégagement d'oxygène plus précises sont disponibles. Elles sont explicitées dans l'encart “Mesure du dégagement d'oxygène”.