La source d'électrons : la photolyse de l'eau
Nous avons appris précédemment que lorsque l'énergie lumineuse collectée par l'antenne collectrice arrive au centre réactionnel, une des deux molécules de chlorophylle de la paire spéciale du centre réactionnel a perdu un électron. Cette molécule se trouve sous forme d'un cation et est instable. Cet électron est injecté dans la chaîne de transporteurs. Le vide électronique ainsi créé doit être comblé par l'apport d'un électron, ce qui rétablit la neutralité électrique de la molécule donneuse. Nous avons également indiqué que ces électrons sont « extraits » de molécules d'eau présentes dans le stroma des thylacoïdes au cours d'un mécanisme appelé la photo-oxydation de l'eau en anglais. Nous allons maintenant découvrir comment ce mécanisme fonctionne. Deux groupes de chercheurs, l'un localisé en France (Joliot et al. 1969) et l'autre aux Etats-Unis d'Amérique (Kok et al. 1970), ont réalisé de manière indépendante, dans les années 1970, des expériences permettant d'élucider les bases de ce mécanisme. Dans cette expérience, des membranes photosynthétiques isolées sont placées à l'obscurité puis illuminées par un train d'éclairs de lumière de courte durée (10 µsec), les éclairs étant séparés les uns des autres par une courte période d'obscurité. Un résultat typique est présenté à la figure 28.
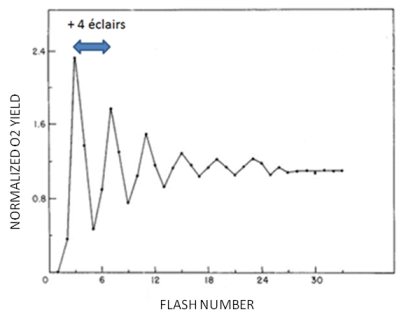
L'illumination de membranes photosynthétiques par un train d'éclairs de 10 µs, chacun séparé par une courte période d'obscurité ne donne pas lieu à une émission continue de l'oxygène. Celle-ci atteint un maximum tous les 4 éclairs. Ceci suggère que la photolyse d'une molécule d'eau requiert un mécanisme à 4 étapes. Le fait que le premier maximum soit observé lors du 3ème éclair suggère qu'à l'obscurité la molécule d'eau est déjà oxydée par un électron.
Il est aisé d'observer que la quantité de dioxygène émis à l'occasion de chaque éclair n'est pas constante mais qu'elle présente une oscillation de périodicité 4. KOK propose que l'émission de dioxygène passe par plusieurs états, qu'il appelle S (Etat = State dans la langue anglaise). Il y aurait donc 5 états S, S0-S4, chacun différent de l'autre par son état d'oxydation, ce dernier reflétant le nombre d'électrons extraits d'une molécule d'eau à l'occasion d'un éclair. Une représentation schématique de la réaction, placée dans son contexte biologique, est présentée dans la figure 29. Le système de dégagement de l'oxygène est localisé dans la lumière (ou lumen) des membranes thylacoïdales. La prise en charge des molécules d'eau permet la formation de l'état S0. Lorsqu'un éclair est absorbé, un premier électron est extrait. Afin de conserver la neutralité électrique un proton est également rejeté dans la lumière des thylacoïdes. C'est l'état S1. Le deuxième électron est extrait lors du deuxième éclair, générant l'état S2.Le troisième éclair provoque l'extraction d'un troisième électron et d'un deuxième proton. C'est l'état S3. Le quatrième éclair permet l'extraction du quatrième électron et la libération des deux protons restant, formant l'état S4. Ce dernier est très instable. La libération de la molécule d'oxygène régénère l'état S0 qui peut lier deux nouvelles molécules d'eau. Chaque électron est utilisé pour combler le vide électronique créé par l'ionisation d'une des deux molécules de chlorophylle du P680. Les protons sont déversés dans la lumière des thylacoïdes qui, en conséquence, s'acidifie (Figure 29). Le mécanisme de photolyse ne fonctionne qu'en présence de manganèse, de chlore et de calcium. Ces éléments sont indispensables pour l'extraction des électrons de la molécule d'eau.
Vous n'aurez pas manqué de remarquer que le premier maximum d'émission d'oxygène apparaît lors du 3ème éclair et que dans le cas précis de l'illumination d'un échantillon placé à l'obscurité, la périodicité de 4 ne s'installe pas immédiatement. Pour expliquer ce résultat, il faut admettre qu'au cours de la période d'obscurité qui précède la salve d'éclairs, l'état S1 est formé, ce qui suggère que les molécules d'eau ont déjà perdu un électron et un proton.
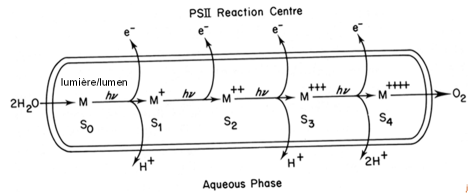
Les molécules d'eau présentes dans la lumière des membranes photosynthétiques entrent en contact avec le système de dégagement de l'oxygène localisé dans ce compartiment. La prise en charge des molécules d'eau permet la formation de l'état S0. Lorsqu'un éclair est absorbé, un premier électron est extrait. Afin de conserver la neutralité électrique, un proton est également rejeté dans la lumière des thylacoïdes. C'est l'état S1. Le deuxième électron est extrait lors du deuxième éclair, générant l'état S2. Le troisième éclair provoque l'extraction d'un troisième électron et d'un deuxième proton. C'est l'état S3. Le quatrième éclair permet l'extraction du quatrième électron et la libération des deux protons restants, formant l'état S4. Ce dernier est instable. La libération de la molécule d'oxygène régénère l'état S0 qui peut lier deux nouvelles molécules d'eau.