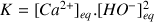Constante d'équilibre
Considérons la réaction générale entre des réactifs A(aq) et B(aq) avec formation des produits C(aq) et D(aq). Toutes ces espèces sont solubilisées comme l'indique le suffixe (aq). Les coefficients stœchiométriques sont respectivement
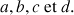
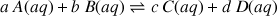
La constante d'équilibre K pour cette réaction s'écrit :
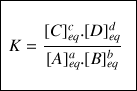
Au numérateur, on porte le produit des concentrations des produits à l'état final, chacune élevée à une puissance qui est le coefficient stœchiométrique rattaché au produit considéré.
Au dénominateur, on porte le produit des concentrations des réactifs à l'état final, chacune élevée à une puissance qui est le coefficient stœchiométrique rattaché au réactif considéré.
Ce rapport de concentrations élevées à la puissance des coefficients stœchiométriques associés n'est valable qu'une fois l'équilibre (c'est à dire l'état final) atteint. On écrit en indice « éq » pour rappeler qu'il s'agit de la concentration de l'espèce chimique considérée dans l'état d'équilibre.
Attention :
En cours de réaction
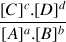

K est une constante sans unité quels que soient les coefficients stœchiométriques
Les concentrations s'expriment en
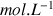
Exemple :
Cette définition de la constante d'équilibre est valable quel que soit l'équilibre chimique considéré.
Voici trois exemples :
Réaction d'estérification entre l'acide éthanoïque et l'éthanol (qui donne l'ester éthanoate d'éthyle) :
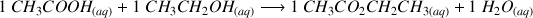
Comme l'eau ici joue le rôle d'un produit et n'est pas le solvant (il s'agit d'une réaction organique qui se fait au départ à l'abri de l'humidité) on va considérer sa concentration pour exprimer K.
On obtient :
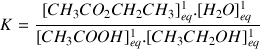
Réaction d'oxydoréduction entre le cuivre et le dichlore :
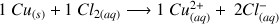
Pour
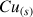 on va considérer la valeur 1 pour exprimer une concentration hypothétique (c'est un solide).
on va considérer la valeur 1 pour exprimer une concentration hypothétique (c'est un solide).On obtient :
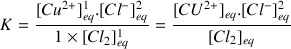
Équilibre de solubilité de l'hydroxyde
| 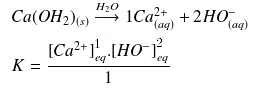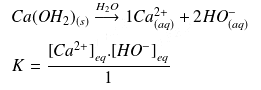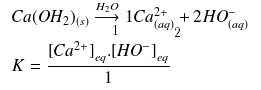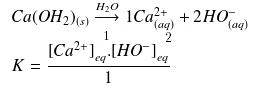 |
Comme le réactif
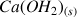 est un solide on va lui attribuer une concentration hypothétique égale à 1.
est un solide on va lui attribuer une concentration hypothétique égale à 1.
On obtient :