Équilibre chimique
Préambule
On étudie les propriétés physiques et chimiques de solutions aqueuses à Pression et Température constantes (P = 1 atm et T = 25 °C, généralement), on utilisera donc les concentrations des espèces solubilisées (sous forme d'ions ou de molécules) pour exprimer les constantes d'équilibres. On indique qu'une espèce est solubilisée par le suffixe (aq).
Dans le cas où dans l'équation chimique sont présents de l'eau en tant que solvant ou des solides, on considérera que leur concentration est égale à l'unité.
Définition : Équilibre chimique
La transformation chimique d'un système atteint un état d'équilibre lorsqu'on observe la coexistence des réactifs et des produits dans l'état final. Cet équilibre chimique correspond à un avancement de la réaction inférieur à l'avancement maximal observé dans le cas d'une transformation totale.
On utilisera comme formalisme la double flèche
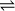 dans l'écriture de l'équation chimique pour signifier que le système va atteindre un état d'équilibre.
dans l'écriture de l'équation chimique pour signifier que le système va atteindre un état d'équilibre.
Cet état d'équilibre est caractérisé par une constante d'équilibre dont la valeur dépend de la température. Généralement on travaillera à 25 °C, température pour laquelle les constantes d'équilibres sont connues pour de très nombreuses réactions.
Sens de la réaction
On définit un sens direct et un sens inverse pour une réaction.
Le sens direct correspond au sens pour lequel les réactifs sont consommés, leur quantité diminue.
Le sens inverse correspond au sens pour lequel les produits sont consommés, leur quantité diminue.
Exemple :
Réaction entre le phénol (acide du couple acide/base
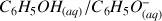 ) et l'eau :
) et l'eau :
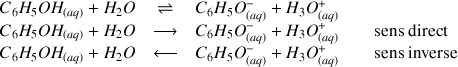
La double flèche indique donc que la réaction peut se faire dans les 2 sens.
Dans l'état final (état d'équilibre) les quantités de produits et de réactifs restent constantes. Elles sont reliées entre elles par la constante d'équilibre associée à la réaction chimique.
Si on ajoute dans le système à l'équilibre
des réactifs : la réaction va se déplacer dans le sens direct
des produits : la réaction va se déplacer dans le sens inverse






