Acide fort dans l'eau et pH
Fondamental :
La réaction acido-basique entre un acide AH et l'eau met en jeu les couples acido-basiques
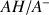 et
et
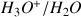 selon la réaction :
selon la réaction :
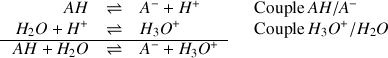
Définition : Acide fort
Dans le cas d'un acide fort la réaction avec l'eau est totale et on utilisera une flèche
 pour l'écriture de l'équation chimique :
pour l'écriture de l'équation chimique :
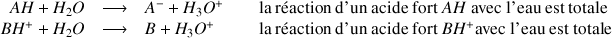
Fondamental :
La réaction de dissociation d'un acide fort dans l'eau est totale, donc dans l'état final, l'avancement est maximal. Comme l'eau est le solvant, l'eau est en quantité très importante. C'est un réactif en excès. L'acide sera donc le réactif limitant. Dans l'état final, la concentration en acide sera donc nulle.
Si la concentration apportée en acide fort est
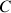 , alors le nombre initial d'acide
, alors le nombre initial d'acide
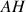 est
est
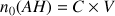 . On négligera l'autoprotolyse de l'eau (on considère que pour
. On négligera l'autoprotolyse de l'eau (on considère que pour
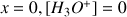 alors qu'en réalité dans l'eau distillée fraîche, avec
alors qu'en réalité dans l'eau distillée fraîche, avec
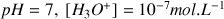 )
)
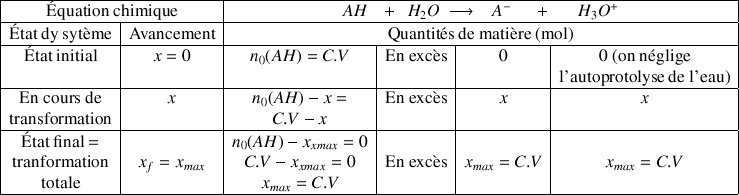
A la fin de la réaction on obtient
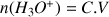 donc
donc
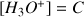 et
et
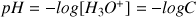
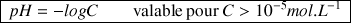
Attention :
La relation n'est valable que si
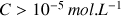 , sinon il n'est pas possible de négliger l'autoprotolyse de l'eau.
, sinon il n'est pas possible de négliger l'autoprotolyse de l'eau.
Ainsi si on considère une concentration apportée en acide de
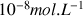 dans de l'eau avec un
dans de l'eau avec un
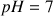 initial, la formule
initial, la formule
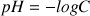 donne
donne
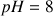 ce qui correspond à une solution basique ! Avant l'introduction de l'acide la concentration en ions
ce qui correspond à une solution basique ! Avant l'introduction de l'acide la concentration en ions
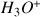 liée à l'autoprotolyse de l'eau (voir section 6, solution neutre) est égale à
liée à l'autoprotolyse de l'eau (voir section 6, solution neutre) est égale à
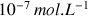 , supérieure à la concentration apportée en acide (si on considère
, supérieure à la concentration apportée en acide (si on considère
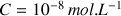 ) donc on ne peut pas la négliger.
) donc on ne peut pas la négliger.






