Autoprotolyse de l'eau
Fondamental :
En plus d'autres ions, toute solution aqueuse contient des ions oxonium
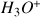 et des ions hydroxyde
et des ions hydroxyde
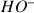 . La concentration des ions
. La concentration des ions
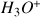 et
et
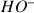 sont reliées entre elles par le produit ionique de l'eau
sont reliées entre elles par le produit ionique de l'eau
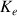 avec :
avec :
 à T=25°C
à T=25°C
Cette relation est toujours valable en solution aqueuse pour des concentrations inférieures à
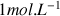 et sert donc principalement à déterminer
et sert donc principalement à déterminer
 à partir de
à partir de
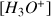 . La concentration
. La concentration
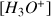 est généralement déterminée par la mesure du pH de la solution.
est généralement déterminée par la mesure du pH de la solution.
La connaissance d'une seule des 2 concentrations suffit pour que les 2 valeurs de concentrations soient connues.
Valeurs limites pour le pH :
Si
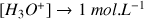
alors
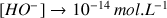 et
et
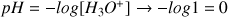
Si
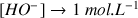
alors
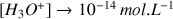 et
et
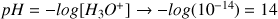
Donc :

Le produit ionique de l'eau
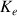 est issu de la réaction acido-basique entre les couples
est issu de la réaction acido-basique entre les couples
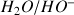 et
et
 (
(
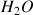 est ici un ampholyte :
est ici un ampholyte :
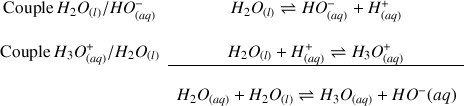
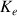 est la constante d'équilibre de cette réaction.
est la constante d'équilibre de cette réaction.
Attention :
On utilise très souvent la valeur
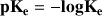
Donc
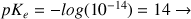
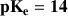
Exemple :
A 25°C, une solution d'hydroxyde de sodium
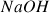 a un pH égal à 11,8. En déduire les concentrations des ions
a un pH égal à 11,8. En déduire les concentrations des ions
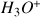 et
et
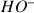 .
.Réponse :
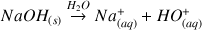
- On connaît le pH donc on peut déterminer
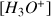 :
:
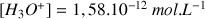
Remarque : la concentration en ions
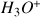 est faible car la valeur du pH est élevée
est faible car la valeur du pH est élevée- Pour déterminer la concentration
 on utilise la relation :
on utilise la relation :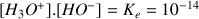
Donc
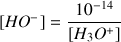
A.N. (Application Numérique)
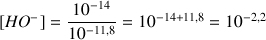
On étudie une solution d'hydroxyde de sodium avec
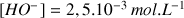 . Calculer son pH à 25°C.
. Calculer son pH à 25°C. Réponse :
- On détermine
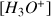 à partir de la relation :
à partir de la relation :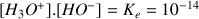
Donc

A.N.
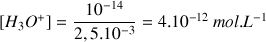
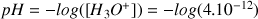

Remarque : la valeur du pH est élevée car la concentration en ions
 est élevée
est élevée






