Couple acide/base
Définition : Acide
Selon la théorie de Brönsted, un acide est une espèce chimique susceptible de libérer au moins un proton
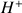 selon les réactions chimiques suivante :
selon les réactions chimiques suivante :
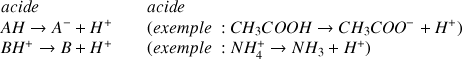
Définition : Base
Selon la théorie de Brönsted, une base est une espèce chimique susceptible de capter au moins un proton
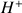 selon les réactions chimiques suivantes :
selon les réactions chimiques suivantes :
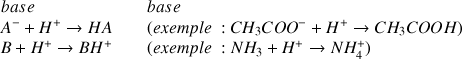
Définition : Couple acide/base, demi-équation
L'acide
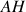 (ou
(ou
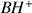 ) qui perd un ion
) qui perd un ion
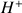 devient une base
devient une base
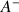 (ou
(ou
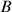 ) que l'on dit conjuguée. L'acide et la base conjuguée forment un couple acide/base
) que l'on dit conjuguée. L'acide et la base conjuguée forment un couple acide/base
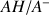 (ou
(ou
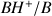 ) auquel on associe la demi-équation chimique :
) auquel on associe la demi-équation chimique :
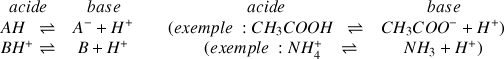
Par convention dans l'écriture d'un couple acide/base on écrit toujours en premier l'acide puis la base.
La double flèche
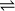 utilisée dans l'écriture de l'équation chimique signifie que la réaction peut se faire dans les deux sens.
utilisée dans l'écriture de l'équation chimique signifie que la réaction peut se faire dans les deux sens.
Définition : Ampholyte, cas de l'eau
Un ampholyte est une espèce chimique qui peut être un acide dans un couple et une base dans un autre. L'eau est un ampholyte, autrement dit un composé amphotère (amphotère est l'adjectif associé au nom ampholyte).

Complément : Acide et base de Lewis
La définition la plus générale d'un acide ou d'une base a été donnée par Lewis :
Un acide est une espèce chimique (ion, molécule) qui peut accepter un doublet électronique, il possède une orbitale vide. On parle de composé électrophile.
Une base est une espèce chimique (ion, molécule) qui peut donner un doublet d'électron, elle possède un doublet non-liant. On parle de composé nucléophile.
La définition de Brönsted d'un acide ou d'une base est basée un échange de proton
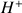 . On utilisera cette approche tout au long de ce cours.
. On utilisera cette approche tout au long de ce cours.






