Base forte dans l'eau et pH
La réaction acido-basique entre une base
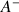 et l'eau met en jeu les couples acido-basiques
et l'eau met en jeu les couples acido-basiques
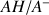 et
et
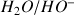 selon la réaction :
selon la réaction :
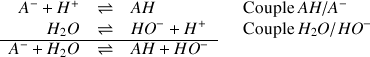
Définition : Base forte
Dans le cas d'une base forte la réaction avec l'eau est totale et on utilisera une flèche
 pour l'écriture de l'équation chimique
pour l'écriture de l'équation chimique
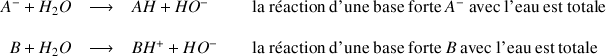
Fondamental :
La réaction de dissociation d'une base forte dans l'eau est totale, donc à l'état final, l'avancement est maximal. Comme l'eau est le solvant, l'eau est en quantité très importante. C'est un réactif en excès. La base sera donc le réactif limitant. A l'état final, la concentration en base sera donc nulle.
Si la concentration apportée en base forte est C alors le nombre initial de base
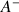 est
est
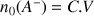 . On négligera l'autoprotolyse de l'eau (on considère que pour
. On négligera l'autoprotolyse de l'eau (on considère que pour
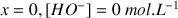 )
)
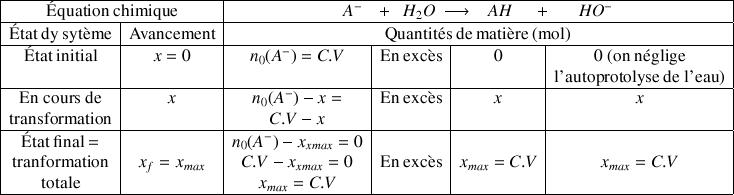
A la fin de la réaction on obtient
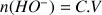 donc
donc
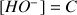
Pour calculer le pH on utilise le produit ionique de l'eau
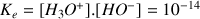
Donc
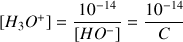
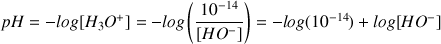

Attention :
La relation n'est valable que si
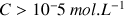 , sinon il n'est pas possible de négliger l'autoprotolyse de l'eau.
, sinon il n'est pas possible de négliger l'autoprotolyse de l'eau.
Ainsi si on considère une concentration apportée en base de
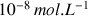 dans de l'eau avec un
dans de l'eau avec un
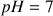 , la formule
, la formule
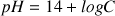 donne
donne
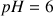 ce qui correspond à une solution acide ! Avant l'introduction de la base la concentration en ions
ce qui correspond à une solution acide ! Avant l'introduction de la base la concentration en ions
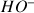 liée à l'autoprotolyse de l'eau est égale à
liée à l'autoprotolyse de l'eau est égale à
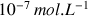 , supérieure à la concentration apportée en base (si on considère
, supérieure à la concentration apportée en base (si on considère
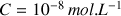 ) donc on ne peut pas la négliger.
) donc on ne peut pas la négliger.






