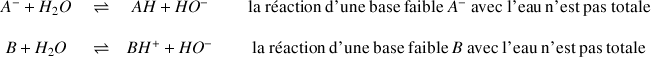Acide faible et base faible
Définition : Acide faible
Dans le cas d'un acide faible la réaction avec l'eau n'est pas totale, elle conduit à un équilibre et on utilisera une double flèche
 pour l'écriture de l'équation chimique :
pour l'écriture de l'équation chimique :
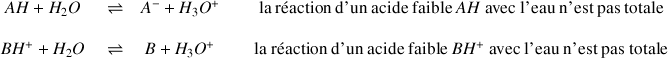
Fondamental :
On observe la même équation chimique que dans le cas de la réaction d'un acide fort sur l'eau. La différence essentielle concerne l'avancement final de la réaction. Dans le cas d'un acide fort il est égal à l'avancement maximal (
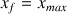 ) et dans celui de l'acide faible il dépend d'une constante d'équilibre (
) et dans celui de l'acide faible il dépend d'une constante d'équilibre (
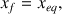 ) et est inférieur à l'avancement maximal.
) et est inférieur à l'avancement maximal.
Définition : Base faible
Dans le cas d'une base faible la réaction avec l'eau n'est pas totale, elle conduit à un équilibre et on utilisera une double flèche
 pour l'écriture de l'équation chimique :
pour l'écriture de l'équation chimique :