Constante d'acidité Ka et pKa
Définition : Constante d'acidité Ka
La constante d'acidité
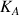 d'un couple acido-basique
d'un couple acido-basique
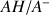 est la constante d'équilibre associée à l'équation chimique.
est la constante d'équilibre associée à l'équation chimique.
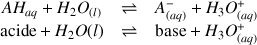
Cette équation chimique est associée à la réaction de l'acide
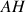 avec l'eau.
avec l'eau.
D'après la définition d'une constante d'équilibre, on a :
Réactifs :
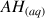 Produits :
Produits :
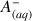 et
et
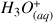
L'eau joue le rôle de solvant (ce n'est pas une espèce aqueuse indiquée par le symbole
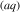 ) donc on lui attribue une concentration hypothétique égale à 1. Tous les coefficients stœchiométriques sont égaux à 1 :
) donc on lui attribue une concentration hypothétique égale à 1. Tous les coefficients stœchiométriques sont égaux à 1 :
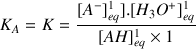

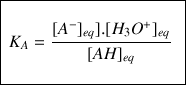
Cette constante d'équilibre appelée
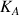 correspond strictement à l'équation chimique ci-dessus.
correspond strictement à l'équation chimique ci-dessus.
A chaque couple acide/base on associe donc une constante d'équilibre
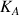
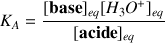 avec
avec
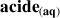
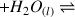
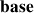
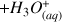
Les valeur de
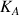 sont connues et répertoriées pour tous les couples acide/base
sont connues et répertoriées pour tous les couples acide/base
Complément : Constante de dissociation de l'eau Ke
La constante
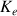 est un cas particulier de
est un cas particulier de
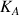 .
.
En effet si on considère le couple acide/base
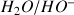
La réaction de l'acide
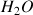 du couple
du couple
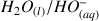 avec l'eau donne :
avec l'eau donne :
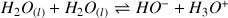 : la constante d'équilibre de cette réaction est
: la constante d'équilibre de cette réaction est
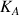 .
.
Donc
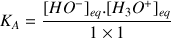 L'eau joue le rôle de solvant
L'eau joue le rôle de solvant
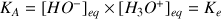 (voir définition autoprotolyse de l'eau).
(voir définition autoprotolyse de l'eau).
Conclusion : Pour le couple
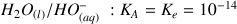
Échelle des pKa
On définit
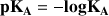 donc
donc
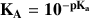
Les valeurs de
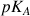 sont comprises dans l'intervalle
sont comprises dans l'intervalle
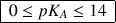
Plus la valeur de
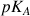 est petite, plus l'acide du couple
est petite, plus l'acide du couple
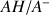 est fort.
est fort.
Plus un acide est fort plus il sera dissocié dans l'eau. La quantité de
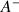 et
et
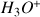 augmente en accord avec la réaction :
augmente en accord avec la réaction :
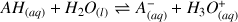
Exemple :
Considérons les couples acide/base suivants :
acide nitreux / ion nitrite

phénol / ion phénolate
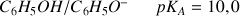
Si on considère une concentration apportée en acide
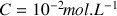 pour les 2 acides de ces couples
pour les 2 acides de ces couples
On observe couple

couple
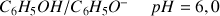
Le pH le plus élevé (solution la moins acide) est observé pour le couple qui possède le
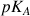 le plus élevé.
le plus élevé.
Ceci s'explique en considérant les valeurs des constantes d'équilibre
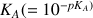 de ces 2 couples
de ces 2 couples
Données : couple

couple
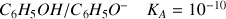
Pour le couple qui possède la plus grande valeur de
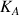 on observera une dissociation plus importante de l'acide donc une concentration plus importante en
on observera une dissociation plus importante de l'acide donc une concentration plus importante en
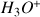 . Cette augmentation de la concentration en
. Cette augmentation de la concentration en
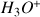 entraîne une diminution du pH.
entraîne une diminution du pH.
On observe couple
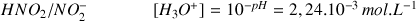
couple
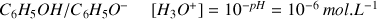
Comme
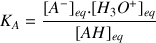 quand
quand
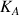 augmente
augmente
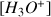 augmente donc pH diminue.
augmente donc pH diminue.
Toutes ces informations sont résumées dans le tableau suivant :
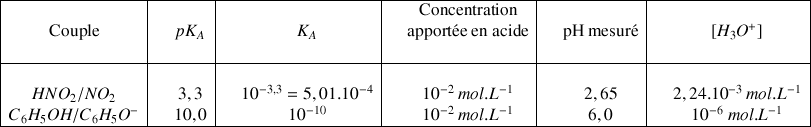
Les valeurs limites de
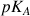 sont observées pour les couples de l'eau :
sont observées pour les couples de l'eau :
Couple
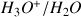
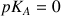
Couple
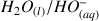
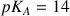
Pour ce dernier couple la réaction de l'acide sur l'eau donne :
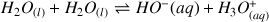
Cette réaction correspond à l'autoprotolyse de l'eau et sa constante d'équilibre est
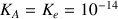
Donc pour le couple
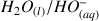
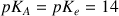
Attention :
Dans le cas d'un acide fort ou d'une base forte, pour le couple acide/acide base il n'y aura pas de
 associé car la réaction est totale, on n'observe pas d'équilibre (donc pas de constante d'équilibre).
associé car la réaction est totale, on n'observe pas d'équilibre (donc pas de constante d'équilibre).






