La production d'ATP dans le chloroplaste
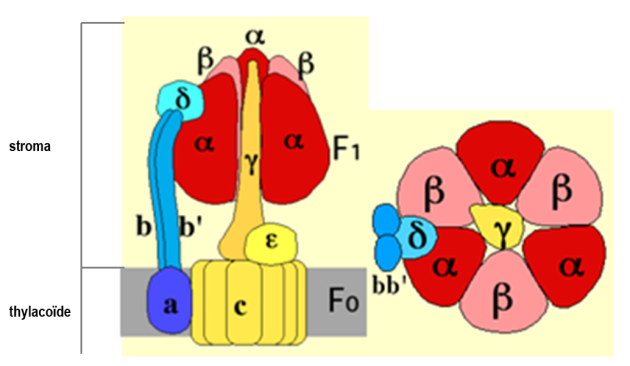
Apport scientifique : La structure de l'ATP synthase L'ATP synthase est une protéine de masse molaire élevée (entre 550 à 650 kDa). Elle est constituée de deux assemblages protéiques : l'un est membranaire (CF0) et le second est localisé dans le stromal (CF1) (Figure 36).
A gauche, vue de profil de l'enzyme montrant les différentes sous-unités et leur position par rapport à la membrane d'ancrage. Notez qu'une sous-unité β a été enlevée pour visualiser l'unité centrale ϒ.
A droite, vue apicale (exposée au stroma) de l'ATP synthétase.
Le CF1
Il s'agit de la partie se trouvant dans le stroma. Elle est donc hydrophile. Le CF1 comprend 5 types de polypeptides, les sous-unités α, β, δ, ϒ et ε (Fig. 36A). La stoechiométrie des sous-unités est 3α, 3β, 1δ, 1ϒ, 1ε. Les sous-unités α et β sont homologues entre elles. La vue apicale présentée à la figure 36B montre une organisation hexagonale dans lequel les sous-unités α et β alternent. Les sites catalytiques sont préférentiellement localisés sur la sous-unités β, à l'interface avec deux sous-unités α. Chaque sous-unité α contient également un site de fixation de l'ATP. Ces sites ne jouent pas de rôle dans la catalyse mais sont impliqués dans la régulation de l'activité de l'ATP synthase.
La sous-unité ϒ forme un axe central joignant le CF0 et le centre de l'hexagone constitué par les sous-unités α et β. A la base de la sous-unité ϒ, du côté CF0, se trouve la sous-unité ε. La sous-unité δ participe à la liaison de l'hexagone formé des sous-unités α et β à la membrane des thylacoïdes.
Le CF0
Il s'agit également d'un complexe multiprotéiques intégré à la membrane des thylacoïdes. La stoechiométrie des sous-unités est 1a, bb', 10c.
Les sous-unités c, très hydrophobes, sont formées de 2 hélices α transmembranaires. L'une de ces hélices renferme un groupement basique pouvant accepter un proton (= protonable), situé en position médiane. Les sous-unités c forment une "couronne" au sein de la membrane (Figure 36A). La sous-unité a forme 2 demi canaux à protons permettant le passage des protons entre les deux faces de la membrane, le passage d'un demi canal à l'autre s'effectuant via les sous-unités c. Les sous-unités b et b' possèdent un segment transmembranaire, qui les ancrent dans la membrane et un domaine très polaire établissent une liaison avec la partie CF1 de l'enzyme via la sous unité δ (Figure 36A).
Apport scientifique : Couplage énergétique |
Mécanisme de changement de liaisons (Modèle de Boyer)
Les nucléotides adényliques[2] ADP et ATP ne se fixent aux sous-unités β qu'en présence de Mg2+. Dans ce mécanisme, les trois sites catalytiques du CF1 changent de conformation de manière séquentielle, chacune des conformations étant caractérisée par une constante d'affinité différente pour les nucléotides (Fig. 37). Les trois conformations sont :
1. la conformation "ouverte", notée O pour "Open" dans la littérature anglo-saxonne. C'est une conformation dans laquelle la libération de l'ATP et l'entrée de nouvelles molécules de substrat sont favorisées,
2. la conformation "relâchée" dans laquelle le site catalytique a une faible affinité pour les nucléotides. Dans la littérature anglo-saxonne, elle est notée L pour "Loose". Dans cette configuration, la liaison des substrats au site catalytique se déroule,
3. la conformation "fermée", dans laquelle le site catalytique a une forte affinité pour les nucléotides. Cette configuration est notée T pour ("Tight") dans la littérature anglo-saxonne. C'est dans cette configuration que la catalyse enzymatique a lieu.
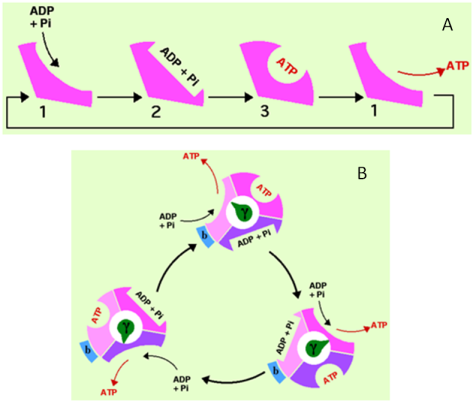
A. Les changements de conformation du site catalytique lors du fonctionnement de l'ATP synthase.
Ce schéma présente la succession des trois conformations des sites catalytiques portés par les sous-unités du CF1. Dans ce modèle, une seule de trois sous-unités β est représentée. Lorsque le site catalytique est dans sa conformation
(ouvert), la libération de l'ATP formé et l'entrée de nouvelles molécules d'ADP et Pi se déroulent
(relâchée), la liaison des substrats ADP et Pi au site catalytique a lieu
(fermé), la formation de l'ATP se déroule
B. Les trois sites catalytiques ne sont pas dans le même état au même moment
Lorsque l'axe central du CF1 - la sous-unité ϒ - tourne, elle induit le changement séquentiel de conformation des sous-unités β. En conséquence, les 3 sous-unités catalytiques sont dans un état différent au même moment.
Il est proposé que la forme irrégulière de l'axe central du CF1 correspondant à la sous-unité ϒ qui est solidaire des sous-unités c du CF0, induit, en tournant de 120°, le changement séquentiel de conformation des sous-unités β. En conséquence, à chaque rotation, une molécule d'ATP est libérée. Donc, au même moment, les 3 sous-unités catalytiques sont dans un état différent (Figure 37B).
Couplage entre le transport de protons et la synthèse d'ATP
Les protons de la lumière des thylacoïdes à transporter entre par la sous-unité a. Chaque proton est ensuite transféré à une sous-unité de la couronne de sous-unités c. La protonation d'une sous-unité c (cN) s'accompagne de la déprotonation de la sous unité c qui la précède (cN-1), le proton issu de la sous-unité cN-1 sortant dans le stroma grâce au demi canal situé du côté stroma de la membrane. Le jeu de l'agitation thermique et des interactions électrostatiques entre les sous unités a et c provoque la rotation de la couronne et de la sous-unité ϒ (Fig. 38). Cette rotation est à l'origine de déformations cycliques des sous-unités catalytiques, et des changements de conformations et d'affinité qui conduisent à la synthèse de l'ATP. L'ATP synthase fonctionne donc comme un moteur moléculaire dans lequel le stator est constitué par les sous-unités α et β du CF1, les sous unités b, b' et δ et la sous-unité a de CF0. Le rotor est constitué de l'anneau des 10 sous-unités c et de l'axe interne du CF1 (sous-unité ϒ, δ, ε) (Figure 38). Le rotor effectue environ 130 révolutions par seconde, chaque rotation complète s'accompagne de la synthèse de trois molécules d'ATP. Le mécanisme de rotation de la " tige ϒ," par rapport à l'anneau formé par les sous-unités α et β a été démontré par Noji et collaborateurs (1997).
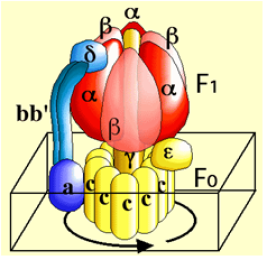
Les différentes sous unités constituant le rotor sont représentées en jaune et les différentes unités constituant le stator, en rouge et bleu. Une sous unité β du stator a été rendue légèrement transparente pour permettre de voir la tige ϒ (jaune sombre).
Vous avez découvert dans les paragraphes précédents qu'au cours de la phase photochimique de la photosynthèse impliquait la libération de protons dans la lumière des thylacoïdes. Une partie de ceux-ci proviennent de la photo-oxydation de l'eau tandis que les autres sont transportés dans le cycle de la plastoquinone. Les mesures démontrent qu'à la lumière, la concentration en protons est plus importante dans la lumière des thylacoïdes que dans le stroma. Il résulte de cette différence un gradient de protons (plus de protons du côté CF0 que du côté CF1) auquel est associé une énergie permettant un flux spontané de protons qui s'effectue, à travers CF0, vers la face de la membrane où se situe CF1 et la synthèse de l'ATP. Grâce à l'ATP synthase, les protons ne s'accumulent généralement pas de manière dangereuse dans la lumière des thylacoïdes, qui peut cependant s'acidifier fortement.
Pour terminer cette partie du cours, je vous engage à regarder les deux vidéos suivantes. La première (https://www.youtube.com/watch?feature=player_detailpage&v=W3KxU63gcF4) présente un modèle animé du fonctionnement de l'ATP synthase. Il est commenté en langue anglaise. Coupez le son et utiliser vos connaissances pour expliquer aux autres étudiants comment l'ATP synthase fonctionne. Vous serez alors certain d'avoir assimilé et compris les notions développées dans cet enseignement.
La seconde animation se focalise sur les réactions moléculaires se déroulant dans les sites catalytiques. Elle présente de manière détaillée les différentes étapes intervenant dans la synthèse de l'ATP à partir de l'ADP et du Pi. La vidéo n'étant pas commentée, vous avez tout le loisir de créer votre propre commentaire et d'impressionner les autres étudiants par vos explications. (https://www.youtube.com/watch?feature=player_detailpage&v=U_mZGTB5uKg)