Le Photosystème I et ses relations avec le photosystème II
Apports scientifiques : nature, structure et fonction du photosystème I |
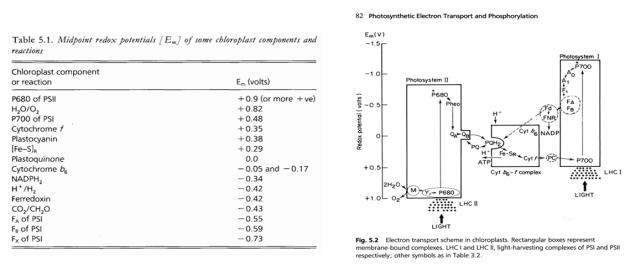
En première approximation, le photosystème I présente une organisation semblable à celle du photosystème II avec un centre réactionnel composé d'un dimère de protéines (PSI-A et PSI-B dans la figure 30). Ce sont de grosses protéines d'environ 80 kD (Tableau 4). Au cœur du complexe est logé la paire spéciale de molécules de chlorophylle a dont nous avons parlé précédemment. Elle est appelée P700 car elle absorbe à 700 nm. Le centre réactionnel du PSI contient plusieurs cofacteurs permettant le transport d'électrons provenant de l'ionisation de l'une des molécules de chlorophylle a du P700 : A0 est une molécule de chlorophylle a, A1 est une phylloquinone tandis que FX est un centre “fer-soufre” du type [4Fe-4S]. Ces centres sont aussi appelés “centres de Rieske”, du nom du scientifique qui les a découverts (Rieske et al. 1964) (Figure 30). Les complexes protéines-pigments LHCI forment l'antenne collectrice de l'énergie lumineuse. La dénomination LHC signifie Light Harvesting Complex ou Complexe collecteur de la lumière (Figure 30). Le photosystème I contient d'autres protéines telles que le polypeptide PSI-I et PSI-J qui remplissent des rôles structuraux. Leur description détaillée sort du cadre de cette ressource. Comme l'illustre la figure 30, cet assemblage de protéines est disposé dans la membrane photosynthétique. Pour la compréhension du mécanisme, il est important de comprendre l'orientation des composants du photosystème I à savoir que le P700 est situé du côté exposé au stroma et que les électrons arrachés à la molécule de chlorophylle du P700 sont acheminés par transfert vers la protéine PSI-C, une protéine exposée au stroma des thylacoïdes du chloroplaste a et contenant deux centres de Rieske, notés FA et FB (Figure 30).
Du point de vue fonctionnel, l'énergie absorbée par l'antenne collectrice de l'énergie lumineuse arrive au niveau du P700 (Figure 30) et provoque l'ionisation d'une des molécules de chlorophylle a de ce dernier. Le P700 est relié électroniquement à la molécule de chlorophylle A0 (Figure 30). Dans la figure 30, les transferts d'électrons sont représentés par les flèches noires. Le transfert d'électrons vers A1, FX, FA et FB aboutit à la ferrédoxine (Fd) une protéine qui contient deux centres “fer-soufre” de type 2Fe-2S. Comme vous le constater sur la figure, la ferrédoxine est amarrée au photosystème I au niveau des deux protéines de structure PSI-D et PSI-E (Figure 30). Dans la langue anglaise, ces protéines sont désignées par le terme “docking proteins”. La traduction n'est pas simple mais nous pourrions les appeler protéines d'amarrage. Ceci suggère que la ferrédoxine est une protéine mobile. C'est en effet le cas, la ferrédoxine apportant les électrons à la ferrédoxine: NADP+ réductase qui assure la réduction du NADP+ en NADPH. Nous reviendrons sur cet aspect un peu plus tard.
Il existe une autre protéine d'amarrage dans le photosystème I. Il s'agit de la protéine PSI-F, exposée à la lumière des membranes photosynthétiques (lumen). Le rôle de cette protéine est de permettre l'ancrage de la plastocyanine (PC dans la Figure 30). Cette petite protéine de 10,5 kD contient un atome de cuivre (Tableau 4). Elle achemine les électrons en provenance du photosystème II.
L'énergie absorbée par l'antenne collectrice de l'énergie lumineuse (LHCI) arrive au niveau du P700 et permet l'extraction d'un électron au P700. Il est transféré à la ferrédoxine (Fd) grâce aux transporteurs fixes A0, A1, FX, FA et FB. La ferrédoxine est amarrée au photosystème I au niveau des deux protéines de structure PSI-D et PSI-E. La ferrédoxine est la protéine mobile apportant des électrons à la ferrédoxine: NADP+ réductase qui les utilise pour réduire du NADP+ en NADPH. Le vide électronique créé au niveau du P700 est comblé par l'apport d'un électron en provenance du photosystème Il. Il est transporté par la plastocyanine. Cette dernière s'arrime à la protéine PSI-F.
Apports scientifiques : la chaîne de transporteurs d'électrons – lien entre PSI et PSII |
Comme nous venons de le percevoir, le photosystème II et le photosystème I sont reliés entre eux par une chaîne de transporteurs d'électrons. Dans ce cours, nous nous intéresserons aux trois transporteurs mobiles : la plastoquinone, la plastocyanine et la ferrédoxine. Le premier d'entre eux est la plastoquinone QB. Elle peut accumuler 2 électrons au maximum. A l'état oxydé, QB est logé dans la pochette appelée (QB-pocket) de la protéine D1 du centre réactionnel du photosystème II (Figure 31).
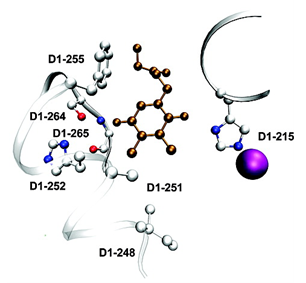
Les rubans blancs représentent la chaîne polypeptidique de la protéine D1. La structure détaillée des résidus d'acides aminés impliqués dans les liaisons électrostatiques sont présentées. Les atomes de carbone, d'azote, d'oxygène et de fer sont respectivement représentés par les boules blanches, bleues, rouges et violettes. La position et la structure de la plastoquinone sont présentées par les sphères de couleur bronze.
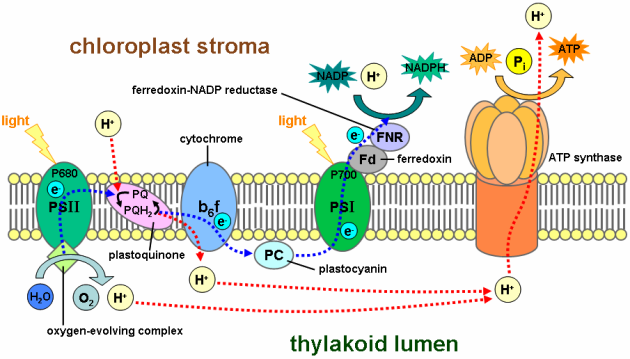
Dans la pochette, QB est lié à la chaîne polypeptidique par des liaisons électrostatiques. Ces dernières sont affaiblies par l'accumulation progressive des électrons sur QB. Lorsque QB a accumulé deux électrons (QB2-), il quitte la pochette et se déplace vers son site d'accueil localisé au niveau du complexe cytochrome b6f. Afin de ne pas confondre la forme attachée de la forme détachée, cette dernière est dénotée PQ. Le site d'accueil de PQ est localisé de l'autre côté de la membrane, ce qui signifie que (PQ2-) doit traverser la bichouche lipidique constituant les thylacoïdes pour se rendre dans cet endroit et délivrer les électrons qu'il transporte. Comme vous l'avez appris pendant vos cours de chimie, les molécules chargées sont hydrophiles et ne peuvent pas traverser les membranes sans transporteurs. Par contre les molécules électriquement neutres peuvent traverser les membranes à conditions qu'elles ne soient pas hydrophiles. C'est le cas de la plastoquinone (Figure 32, encart 8). Pour atteindre la neutralité électrique, PQ2- lie deux protons du stroma du chloroplaste lorsqu'il quitte le photosystème II et c'est donc PQH2 qui traverse la membrane pour s'attacher au cytochrome b6f au niveau de la pochette QZ (Figure 32). Une fois arrimé, les deux électrons sont transférés au cytochrome b6f tandis que les deux protons sont déversés dans la lumière des thylacoïdes. Ces deux mouvements de charges régénèrent PQ, qui peut alors migrer vers son point d'origine. Si vous imaginez les mouvements de PQ, vous comprenez aisément pourquoi ils sont désignées commle cycle de la plastoquinone. Les électrons donnés au cytochrome b6f sont pris en charge un par un par une molécule de plastocyanine. Il s‘agit d'une petite protéine localisée dans la lumière des thylacoïdes et contenant un atome de cuivre. Elle sert à véhiculer les électrons jusqu'au photosystème I (Figure 33) au sein duquel ils sont utilisés pour combler transitoirement le vide électronique créé au niveau du P700 (voir le paragraphe précédent), avant d'être propulsé à leur tour vers la ferrédoxine (Fd). La ferrédoxine est une protéine mobile qui achemine les électrons du photosystème I vers la ferrédoxine NADP+ oxydoréductase (Figure 32).
Apports scientifiques : le schéma en Z |
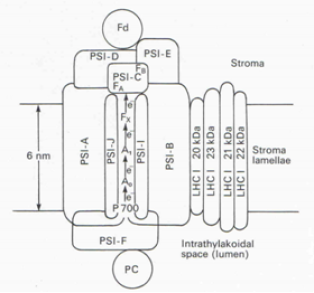
Nous avons appris ci-dessus qu'une fois l'électron arraché à la molécule du P680, il est transféré de transporteur en transporteur jusqu'à aboutir à la formation du NADPH. La présence d'un ou plusieurs électrons supplémentaires sur un transporteur modifie l'état d'oxydoréduction du transporteur. La valeur de ce potentiel est caractéristique du transporteur (Tableau 4). L'examen attentif des potentiels rédox présentés dans le tableau montre que le potentiel qui correspond à l'oxydation de l'eau (H2O → O2) est très important avec un potentiel rédox de + 0.82 V tandis que celui de Fx est très faible (- 0.73 V). Comme vous le constaterez en étudiant le tableau 4, les potentiels rédox des transporteurs participant au processus photosynthétique se trouvent dans cette fourchette.
Comme vous l'avez appris pendant vos cours de chimie, un transfert d'électrons entre deux couples redox s'effectue spontanément dans le sens croissant des potentiels redox. L'organisation des transporteurs d'électrons, rangés en accord avec leur potentiel d'oxydoréduction forment la lettre Z qui a donné son nom à ce type de diagramme: le schéma en Z (Figure 33). Or, le transfert d'un électron vers la phéophytine a à l'aide d'un électron provenant de l'eau nécessite un apport d'énergie équivalent à 1,5 V. L'énergie nécessaire provient des photons capturés par l'antenne collectrice de l'énergie lumineuse et dont l'énergie est transférée aux centres réactionnels. L'énergie associée à l'électron sera progressivement dissipée au cours des différentes réactions d'oxydoréduction impliquées dans chaque transfert. Lorsque les électrons sont pris en charge par la plastocyanine, l'énergie associée n'est plus suffisante pour permettre la réduction du NADP+. Il est donc nécessaire d'associer plus d'énergie à ces électrons. C'est le rôle du photosystème I.
Le potentiel d'oxydoréduction de chaque transporteur est indiqué sur l'axe Y. Les réactions d'oxydoréduction se déroulent spontanément lorsque l'on passe d'un potentiel d'oxydoréduction positif vers un potentiel plus petit. Par exemple, le transfert d'un électron du P680 vers la phéophytine a à l'aide d'un électron provenant de l'eau nécessite un apport d'énergie équivalent à 1,5 V. Cette énergie provient des photons capturés par l'antenne collectrice de l'énergie lumineuse et dont l'énergie est transférée aux centres réactionnels. L'énergie associée à l'électron est progressivement dissipée au cours des différentes réactions d'oxydoréduction impliquées dans chaque transfert. Lorsque les électrons sont pris en charge par la plastocyanine, l'énergie associée n'est plus suffisante que pour permettre la réduction du NADP+. Il est donc nécessaire d'associer plus d'énergie à ces électrons.