6.3.4- La migration cellulaire
Les cellules du mésoderme qui s'invaginent, adhèrent à la matrice extracellulaire (MEC). La matrice extracellulaire est composée d'un réseau de fibrilles entrecroisées dans les trois dimensions de l'espace. Elle se complexifie à mesure que la gastrulation progresse (Fig.154), puis remplit les espaces qui délimitent les ébauches d'organes lors de l'organogenèse. Elle est étroitement associée aux mécanismes de l'adhérence cellulaire, aussi bien pendant la gastrulation que plus tard, lors de la migration des cellules de la crête neurale.
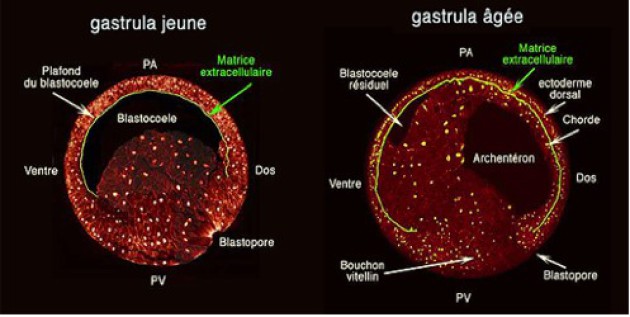
On peut la mettre en évidence par immunofluorescence indirecte grâce à un anticorps polyclonal dirigé contre un de ses composants principaux, la fibronectine (fn). Ainsi, des coupes sagittales réalisées du début à la fin de la gastrulation montrent qu'elle tapisse le plafond du blastocoele, puis se retrouve « coincée » entre l'ectoderme et le mésoderme lors de l'invagination de ce dernier.
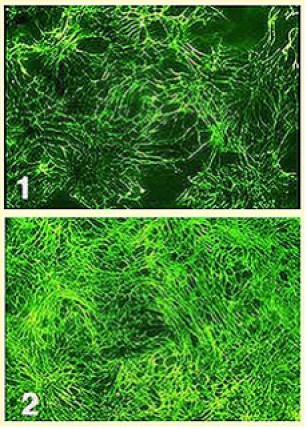
On peut également prélever le toit du blastocoele et montrer in toto la nature fibrillaire tridimensionnelle de la matrice extracellulaire en révélant la fibronectine (Fig.155). En microscopie optique à fluorescence comme en microscopie électronique à balayage, on perçoit un enchevètrement de fibrilles organisées en réseau. Chez le pleurodèle, on voit les fibrilles se former à la jonction des cellules du toit du blastocoele dès le stade blastula jeune. Ces fibrilles croissent de manière centripète (1). La densité de ce réseau augmente pendant la gastrulation (2).
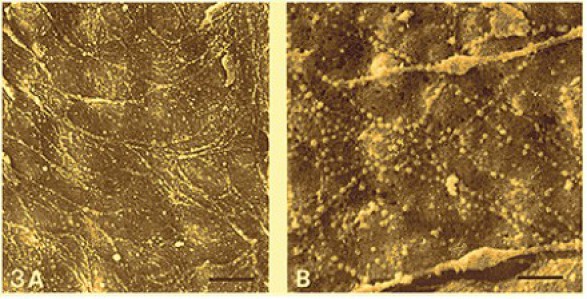
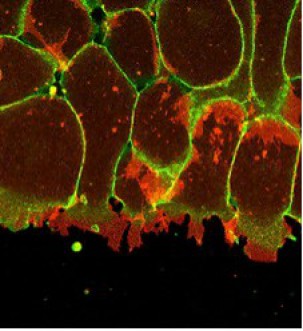
A un plus fort grossissement, au microscope électronique à balayage, l'anticorps anti-fibronectine marqué avec des particules d'or colloïdal démasque les fibrilles en connexion avec les extrémités filopodiales des cellules mésodermique en migration (Fig.156). Les filopodes, expansions ultimes des pseudopodes, interagissent avec les fibilles de la matrrice extracellulaire (Fig.157). La zone de contact entre les filopodes et les fibrilles de matrice extracellulaire porte le nom de points focaux (Fig.158).
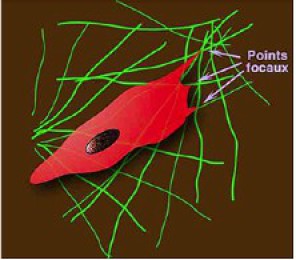
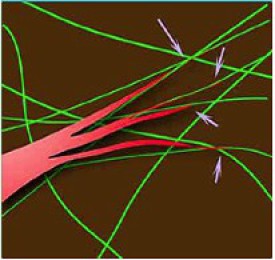
Les cellules migrantes modifient leur forme grâce à l'allongement et la rétractation de ces pseudopodes. Le cytosquelette en est l'élément moteur.
La membrane plasmique comporte des protéines transmembranaires réceptrices faisant partie de la famille des intégrines (Fig.159). La reconnaissance de la fibronectine par ces récepteurs au niveau des points focaux permet à la cellule d'adhérer à la matrice extracellulaire.
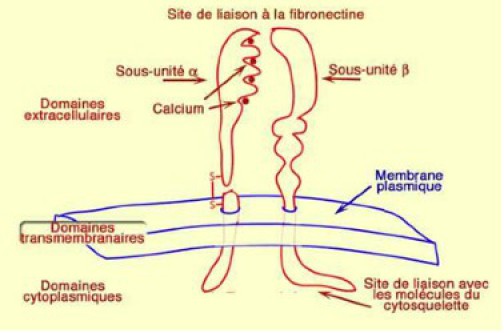
Deux sous-unité α et β (α5β1) composent le récepteur à la fibronectine. Leur configuration stérique comporte une région extracellulaire une région extracellulaire que l'on appelle le domaine de liaison à la fibronectine. Du côté cytoplasmique, les sous-unités α et β interagissent avec des protéines du cytosquelette.
Les intégrines sont ainsi regroupées en plaque d'adhésion où les extrémités cytoplasmiques de la sous unité β se lient à la taline et la vinculine, molécules articulées à l'actine fibrillaire, protéine contractile abondante dans le cytoplasme cortical (Fig.160). Des molécules de signalisation sont également associées à ces région des molécules d'intégrines.
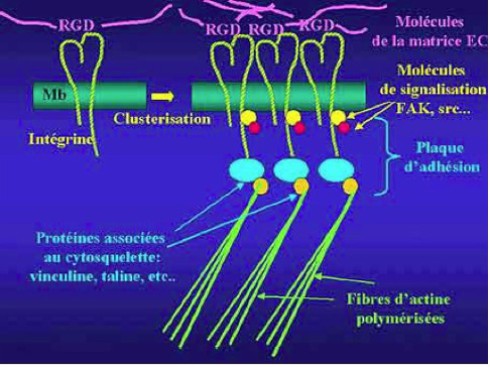
Les intégrines apparaissent ainsi comme des intermédiaires transmembranaires susceptibles de transmettre un signal médié par une ou plusieurs voies de transduction associées à un comportement d'adhérence mu par le cytosquelette et généré par la reconnaissance de la fibronectine.
Les régions extracellulaires interagissent avec les molécules de fibronectine portées par les filopodes au niveau des points focaux. Glycoprotéine multifonctionnelle, dimérisée, de haut poids moléculaire (220kDa), la fibronectine est composée de six domaines fonctionnels.
De l'extrémité N-terminal vers l'extrémité C-terminal, on distingue, un domaine de liaison à l'héparine, puis un domaine se liant au collagène. Suit un domaine de liaison à la fibrine. Le domaine suivant nous intéresse plus particulièrement puisqu'il interagit avec les intégrines, c'est le domaine de liaison à la cellule. Enfin, un double domaine de liaison à l'héparine et à la fibrine termine la séquence d'un monomère de fibronectine. La dimèrisation est assurée par deux ponts disulfures à l'extrémité C-terminal (Fig.161).
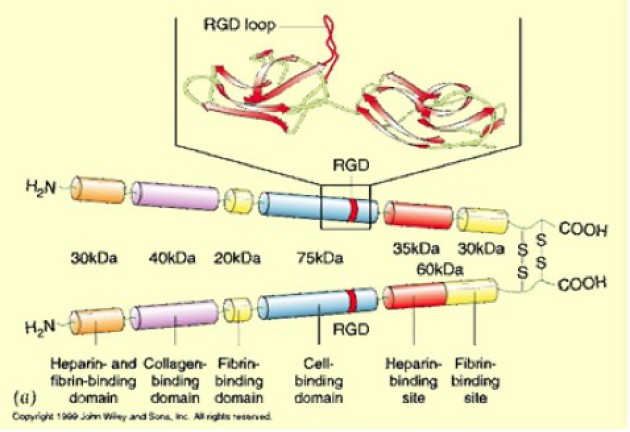
La structure fonctionnelle de la fibronectine montre que cette molécule est impliquée dans de multiples processus interactifs avec les molécules de la matrice extracellulaire (collagène) mais aussi avec des molécules du sang circulant (fibrine, héparine) (Fig.162). D'ailleurs, la fibronectine est une des composantes moléculaires du plasma sanguin où, avec la fibrine et l'héparine, elle participe à la régulation de la fluidité sanguine et à la formation du caillot. Le plasma sanguin peut d'ailleurs être considéré comme une matrice extracellulaire particulière dans la mesure où elle est liquide.
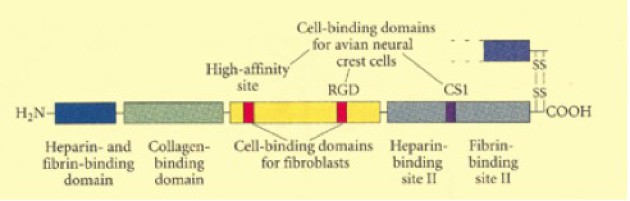
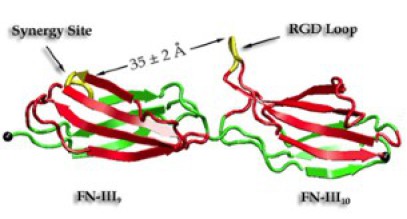
Le domaine de liaison à la cellule mésodermique comporte des séquences reconnues par les intégrines α5β1. Le tripeptide RGD (arginine, glycine, asparagine) situé côté C-terminal est nécessaire à l'adhérence cellulaire.
Côté N-terminal, un site de haute affinité entre en synergie avec le précédent (Fig.162, Fig.163).
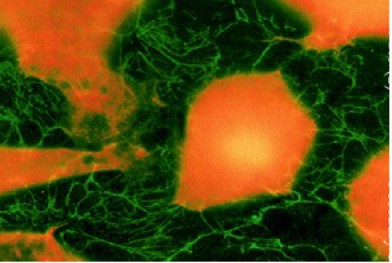
D'un point de vue comportemental, les cellules passent d'abord par une phase d'étalement sur la matrice extracellulaire (Fig.164).

Puis, les cellules progressent sur la matrice extracellulaire en régulant le nombre et l'emplacement de leurs point focaux (Fig.165).
L'actine fibrillaire se concentre dans le cytoplasme cortical au niveau du bord de progression de la cellule et participe activement à l'extension des filopodes.
Le mécanisme de progression de la cellule en migration est le suivant (Fig.166):
Extension d'un pseudopode exploratoire
Contact avec la matrice extracellulaire, création d'un point focal : adhésion
Translocation du corps cellulaire
Séparation du point focal postérieur : désadhésion.
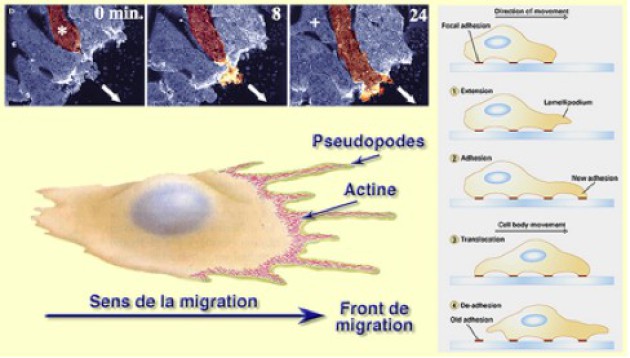
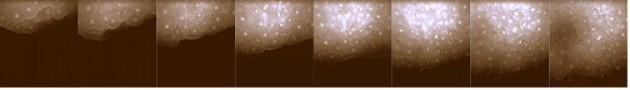
En culture, le front de migration montre une activité protrusive intense. Les cellules émettent des vagues de lamellipodes exploratoires qui finissent par se fixer sur le substrat. Les corps cellulaires prennent appui sur ces lamellipodes et avancent dans le sens de la migration. L'image suivante permet de prendre conscience de ce phénomène, notamment par le marquage en rouge de l'actine associé aux lamellipodes (Fig.167-video3).
De cette façon, le front de migration progresse sur la matrice extracellulaire, entraînant avec lui l'ensemble des cellules mésodermiques organisées en nappe comme sur cette séquence filmée en culture (Fig.168-video4).
Expérimentalement, on peut montrer que la matrice extracellulaire est indispensable à l'adhérence des cellules mésodermiques.
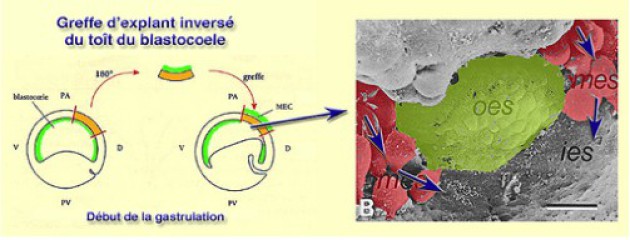
Par microchirurgie on prélève un explant du pôle animal que l'on réimplante à la même place mais à l'envers. Ainsi le plafond du blastocoele est composé à cet endroit par l'extérieur de l'ectoderme et est donc dépourvu de matrice extracellulaire. L'examen en microscopie à balayage montre que la surface de l'explant est dépourvue de cellules en migration. Ces dernières contournent l'explant là où la matrice extracellulaire est présente (Fig.169).
Des expériences d'inhibition fonctionnelle ont été réalisées afin de montrer le rôle de la fibronectine dans l'adhérence des cellules mésodermiques sur la matrice extracellulaire.
Des anticorps polyclonaux ou monoclonaux sont élaborés à partir de fibronectine plasmatique. Après purification, ils sont microinjectés dans le blastocoele d'une jeune gastrula. 24 heures après l'injection, l'embryon présente un phénotype fortement perturbé.
L'invagination est inhibée, la masse endodermique fait hernie et l'ectoderme ne s'étale pas à la surface de l'embryon. Au total, les mouvements de migration du mésoderme sont inhibés ce qui bloque l'invagination. Quant à l'ectoderme, il ne bénéficie pas du support de la matrice extracellulaire pour effectuer les mouvements d'épibolie (Fig.170).
La spécificité de la liaison est dûe au domaine de liaison de la fibronectine à l'intégrine α5β1 (RGD). On peut montrer à quel point cette liaison est spécifique en praitiquant une expérience d'inhibition fonctionnelle.
L'expérience consiste à injecter, dans le blastocoele d'une jeune gastrula de pleurodèle, une solution de peptides de synthèse de séquence RGDS (arginine, glycine, asparagine, sérine). Les peptides sont reconnus par les intégrines α5β1 et saturent les sites de reconnaissance à la fibronectine.
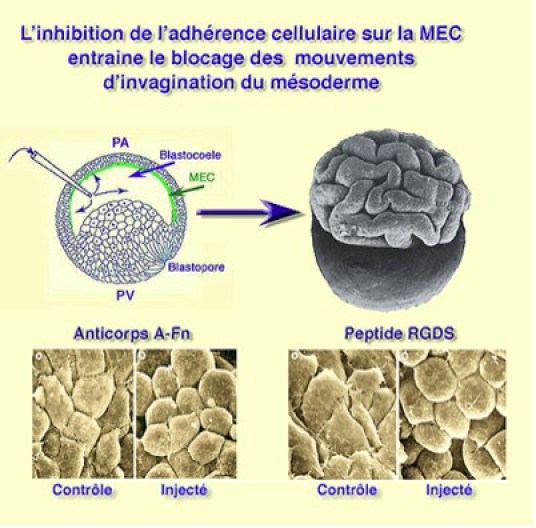
Leur fonction est donc inhibée, et les cellules mésodermiques ne sont plus capables d'adhérer à la matrice extracellulaire. La conséquence est un blocage des mouvements d'invagination qui entraîne un blocage de la morphogenèse de l'embryon. 24 heures après l'injection, l'embryon présente un phénotype d'exogastrula avec l'endoderme externe proéminent et un ectoderme fortement plissé. Les symptômes sont donc les mêmes qu'avec les anticorps. On remarque également dans les deux cas que les cellules s'arrondissent et perdent progressivement le contact avec le toit du blastocoele. Dans le 2ème cas, il n'est pas rare de trouver des cellules mésodermiques détachées qui tombent sur le plancher du blastocoele.






