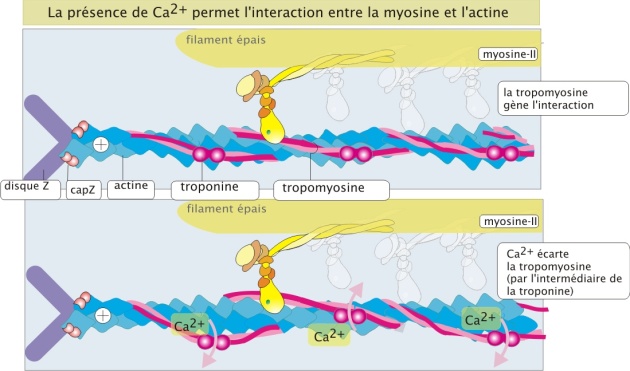
Le Ca2+ et la troponine/tropomyosine-II interviennent dans la régulation de la contraction du muscle
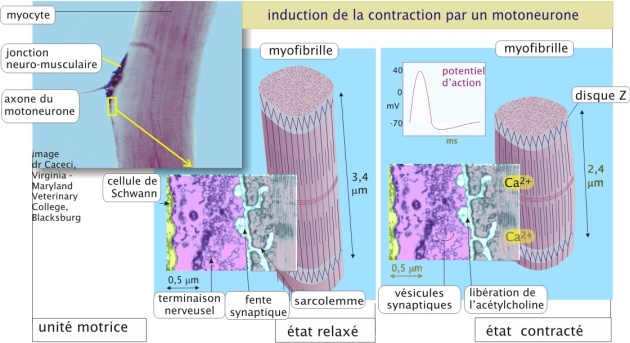
L'interaction actine/myosine est hautement régulée pour prévenir les contractions musculaires indésirables (par exemple, imaginez les conséquences désastreuses sur la respiration d'une contraction des muscles intercostaux maintenue pendant quelques minutes). La contraction du muscle squelettique est déclenchée par des motoneurones qui forment des synapses spécialisées, les jonctions neuro-musculaires (ou plaques motrices) (figure 14 ci-dessous). L'ensemble constitué par un motoneurone et une ou quelques cellules musculaires est appelé « unité motrice ». Le système nerveux influence la force de contraction d'un muscle :
en mobilisant plus au moins d'unités motrices et
en réglant la fréquence d'activation de chacune de ces unités motrices (avec un maximum de 200 potentiels d'action car chaque cycle dure 50 millisecondes) (revoir aussi , section « Neurotransmission. Le récepteur nicotonique à l'acétylcholine » de la ressource « transport membranaire »).
La stimulation nerveuse des cellules musculaires entraine une augmentation de la concentration intracellulaire en Ca2+ qui représente le signal de contraction. La dépendance de la contraction des muscles squelettiques à l'égard des ions Ca2+ est entièrement due à une catégorie de protéines accessoires étroitement associées aux filaments d'actine. Une de ces protéines accessoires est la troponine (18 kDa), qui fixe le Ca2+. La deuxième est la tropomyosine-II (35 kDa), constituée de deux chaînes protéiques enroulées autour du filament d'actine et pouvant masquer ou démasquer le site de liaison actine/myosine-II. En absence de Ca2+ la tropomyosine-II empêche la tête de myosine-II d'interagir avec les filaments d'actine et en présence de Ca2+, et sous influence de la troponine, la tropomyosine-II se déplace légèrement, permettant ainsi l'interaction entre actine et myosine-II (figure 15 ci-dessous).
Remarque : Le cycle de modification de la myosine en absence de Ca2+ (état de repos)
En absence de Ca2+, le cycle d'hydrolyse de l'ATP se déroule mais de façon plus lente (environ 1000 fois). En effet, les têtes de myosine-II restent plus longtemps dans l'état de liaison ADP + Pi avant que le Pi et l'ADP soient libérés et remplacés par une nouvelle molécule d'ATP. C'est le contact actine-myosine-II qui accélère la perte de Pi et ADP et donc le cycle d'hydrolyse.
On peut ainsi prendre conscience de l'énorme demande d'ATP (1000 fois) lorsque le muscle se contracte, une demande qui doit être compensée par une production mitochondriale équivalente, de façon à éventuellement soutenir une contraction prolongée.