Les fonctions des filaments d'actine
Par des exemples spécifiques nous illustrons ci-dessous quelques fonctions des filaments d'actine.
Exemple : Migration cellulaire
Comme nous l'avons vu dans la ressource « molécules d'adhérence », aux sites d'infection, les leucocytes quittent la circulation pour s'infiltrer dans les tissus. Là, attirés par les peptides N-formylés perdus par les bactéries, ils gagnent la source d'infection. Les mouvements nécessaires à ce déplacement se font grâce au cytosquelette et à l'actine en particulier. L'actine joue un rôle dans la formation des lamellipodes résultant d'un phénomène de protrusion membranaire (figure 5 ci-dessous). Le réseau d'actine périphérique sous-membranaire sert d'appui à la polymérisation de nouveaux filaments qui repoussent la membrane, formant ainsi progressivement le lamellipode. Les sites d'initiation de la polymérisation (sites de nucléation) sont désignés par l'activation de ARP2/3 qui pour sa part est sous l'influence des récepteurs membranaires aux peptides N-formylés (chémokine). Les lamellipodes sont des extensions dynamiques des leucocytes qui leur permettent de se déplacer sur une surface. Ils se forment (et disparaissent) en quelques secondes, témoignant de la dynamique rapide de la polymérisation et dépolymérisation de l'actine.
![]() Voir une version 3D animée de la migration cellulaire
Voir une version 3D animée de la migration cellulaire
Macromedia Flash - 3,3Mo
Podosomes, les structures d'actine spécialisées dans la dégradation de la matrice
Le cytosquelette d'actine joue également un rôle dans la dégradation de la matrice extracellulaire. Il s'agit d'un processus essentiel du remodelage tissulaire combinant migration cellulaire et digestion matricielle. Le processus est également responsable de la diffusion indésirable des cellules cancéreuses. Dans le contexte physiologique, on peut citer le remodelage de l'os par les ostéoclastes, la réparation des tissus endommagés par les macrophages ou le processus d'angiogenèse dans lequel les cellules endothéliales envahissent de de nouveaux territoires pour les vasculariser. Les structures d'actine impliquées dans ces processus sont appelés podosomes (figure 4-09b). Ce sont des structures cylindriques, s'élevant perpendiculairement à la membrane ventrale de la cellule. Ces microdomaines d'actine recrutent des métalloprotéinases (MMPs), transmembranaires, liées à la membrane ou secrétées dans le milieu. Ce sont des enzymes qui décomposent le collagène (collagénases) ou la gélatine (gélatinases), l'élastine (élastase) ou un mélange de composants tels que les protéoglycanes, la laminine, la fibronectine et les collagènes de types IV et IX (stromélysines). Dans les cellules cancéreuses, les structures d'actine de meme type prennent le nom d'invadopodes, par référence à leur rôle dans l'invasion tissulaire. Une expression accrue de stromélysine-3 (MMP11) est un facteur pronostique de l'agressivité des tumeurs (du sein, du côlon, du poumon, de l'ovaire et d'autres).
Pour en savoir plus, consultez le « Nature Cell Migration Gateway » :
ou consultez l'encyclopédie A-Z des protéines liant l'actine :
![]() Pour en savoir plus sur la dynamique du cytosquelette, en particulier dans le contexte de la migration cellulaire, nous proposons les articles suivants :
Pour en savoir plus sur la dynamique du cytosquelette, en particulier dans le contexte de la migration cellulaire, nous proposons les articles suivants :
« Cell Migration Scita [pdf] » (545 Ko).
« Cell Migration Review Rottner [pdf] » (2285 Ko).
« Actin Assembly Review Pollard [pdf] » (538 Ko).
« Wasp Wave ARP3-3 Miki [pdf] » (268 Ko).
« Formin Nucleation Zigmund [pdf] » (606 Ko).
« Cdc42 Opening Wasp Ahmadian [pdf] » (791 Ko).
Une brève histoire, en anglais, d'un des pionniers dans les études de la migration cellulaire, Michael Abercrombie, qui montre comment la passion pour la recherche peut arriver à surpasser les carences financières institutionnelles :
« Potted History Abercrombie [pdf] » (23 Ko).
Exemple : Traction sur la matrice extracellulaire
Les faisceaux contractiles d'actine forment des fibres dites « de tension » dans les fibroblastes tissulaires (tissu conjonctif) les rendant capables de se contracter et d'exercer ainsi une traction sur la matrice extracellulaire qui les entoure. Ce processus est essentiel pour entamer la cicatrisation au cours de laquelle les deux lèvres de la blessure doivent progressivement être rapprochées. Par l'intermédiaire de complexes moléculaires d'adhérence regroupés aux sites appelés contacts focaux, les filaments d'actine sont reliés à la matrice extracellulaire (fibronectine, laminine et collagène). La molécule principalement impliquée est l'intégrine qui, grâce à un complexe de molécules de liaison (taline, vinculine et -actinine) est fixée au cytosquelette d'actine (figure 6 ci-dessous) (revoir aussi la de la ressource « les molécules d'adhérence »).
Exemple : Cytodiérèse
En fin de mitose, après que les chromosomes se soient séparés grâce aux microtubules (télophase), les filaments d'actine forment en périphérie de la cellule et perpendiculairement à l'axe du fuseau mitotique (microtubules), un faisceau contractile appelé anneau contractile. Quand l'anneau se contracte (comme le cordon d'une bourse) il sépare la cellule mère en deux cellules filles (cytodiérèse).
Exemple : Maintien de l'intégrité tissulaire et participation aux mouvements des feuillets embryonnaires
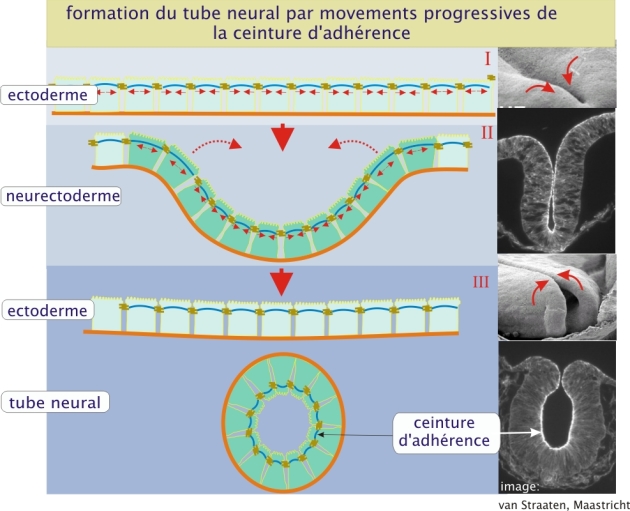
Comme cela est montré dans la ressource « molécules d'adhérence », les filaments d'actine sont un composant important de la ceinture d'adhérence. Ces filaments sont arrangés sous forme de faisceaux contractiles. En associant les éléments du cytosquelette d'une cellule à ceux d'une autre, cette ceinture permet à l'épithélium de résister aux agressions mécaniques (figure 7 ci-dessous) (revoir aussi la et l', issus de la ressource « les molécules d'adhérence »).
En plus de ce rôle utile de résistance tissulaire, les faisceaux contractiles des ceintures sont à l'origine de mouvements tissulaires au cours de l'embryogenèse. La formation du tube neural en est un exemple représentatif. C'est en effet la contraction des ceintures qui provoque l'affaissement du feuillet neuro-ectodermique, donnant ainsi naissance à la gouttière neurale puis au tube neural (figure 8 ci-dessous).
Exemple : Armature des microvillosités
Les bordures en brosse des cellules épithéliales digestives sont formées de microvillosités. Ces différenciations résultent en une augmentation considérable de la surface cellulaire apicale, facilitant ainsi la capture des nutriments dans le tube digestif (pour exemple, revoir le transport du glucose par SGLT1, et , issus de la ressource « transport membranaire »).
Ces microvillosités possèdent une armature constituée de filaments d'actine associés en faisceaux parallèles, orientés côté + distal et liés par la fimbrine. Ces filaments sont stabilisés par des protéines de coiffage qui se trouvent à leurs extrémités. Les filaments sont ancrés sur un réseau de filaments périphériques sous-membranaires (actine corticale) (figure 9 ci-dessous).