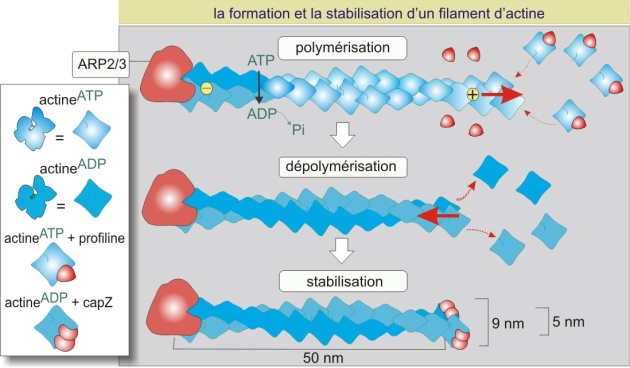
La polymérisation de l'actine
L'actine se polymérise (en présence d'ATP) en une hélice serrée de 5-9 nm de diamètre formant un filament flexible et polaire. Lorsque l'on solubilise l'actine en présence de KCl, ATP, Mg2+ et d'un catalyseur tel que le complexe ARP2/3 qui permet de fixer les premiers monomères (amorce), elle forme spontanément des polymères (filament d'actine ou actine-F). La croissance du filament est très rapide (1000 actines/s) au pôle plus et très lente, voire absente, au pôle moins. Après la polymérisation, une hydrolyse aléatoire de l'ATP a lieu, le phosphate (Pi) est libéré et l'ADP qui en résulte reste piégé dans le polymère. Les molécules d'actine liées à l'ADP ont tendance à se détacher du polymère aux extrémités des filaments. Les monomères d'actine ainsi libérés doivent être rechargés en ATP avant de rejoindre le filament (figure 2 ci-dessous).
![]() Voir une version 3D animée de la polymérisation de l'actine
Voir une version 3D animée de la polymérisation de l'actine
Macromedia Flash - 3,3Mo
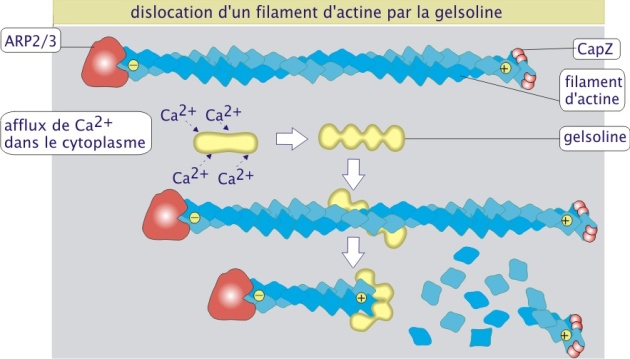
In vivo, la polymérisation de l'actine est contrôlée par de nombreuses protéines, comme la profiline, le complexe ARP2/3, CapZ et la gelsoline (figure 2 ci-dessus). La profiline (15 kDa) se fixe à l'actine monomérique liant alors l'ATP et aidant à la réintégration de l'actine dans le polymère. Le complexe protéique ARP2/3 (Actin Related Proteins 2 et 3, de 42 et 47 kDa respectivement) est impliqué dans l'initiation de la polymérisation. Le complexe se fixe côté moins de l'actine et sa présence favorise la formation d'une amorce constituée de trois monomères liés entre eux (site de nucléation pour la formation de longs polymères). L'ARP2/3 joue donc un rôle important dans la désignation des sites où l'actine doit se polymériser. Les pôles plus et moins des filaments peuvent être protégés par les protéines de coiffage (capping). Ces protéines empêchent l'actine, dans son état ADP, de quitter le polymère mais empêchent aussi sa polymérisation dans son état ATP. CapZ, constituée d'un dimère de deux sous-unités (alpha, 34 kDa, et beta, 30 kDa), se fixe au pôle plus, évitant ainsi la croissance rapide. La tropomoduline (40 kDa) se fixe au pôle moins, évitant ainsi la croissance lente. CapZ et tropomoduline, comme on le verra plus tard, jouent un rôle important dans la stabilisation des polymères d'actine-\(\alpha\) dans les muscles striés (en créant un polymère peu dynamique). Enfin, la gelsoline (82 kDa), en présence d'une concentration élevée de Ca2+ cytosolique, se fixe au polymère d'actine et crée une coupure engendrant la dislocation du filament d'actine. La gelsoline reste fixée à l'extrémité plus, évitant ainsi la repolymérisation rapide (figure 3 ci-dessous)
![]() Voir une version 3D animée de la dislocation d'un filament d'actine par la gelsoline
Voir une version 3D animée de la dislocation d'un filament d'actine par la gelsoline
Macromedia Flash - 8,2Mo
Remarque : Phalloïdine
En se fixant aux filaments d'actine, la toxine phalloïdine, provenant du champignon Amanita phalloïdes, s'oppose à leur dépolymérisation, causant ainsi leur accumulation et donc le dysfonctionnement des cellules. L'effet toxique est essentiellement dû aux atteintes rénales et hépatiques.