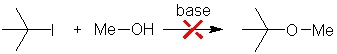6.9 Éther oxydes
Ethers α-halogénés : Dans notre cas il y a formation d'un éther propargylique.
Synthèse de Williamson : Cette synthèse permet de préparer des éthers oxydes par des réactions de substitutions nucléophiles. En général, le mécanisme de cette réaction est un mécanisme SN2.
Ainsi pour préparer l'éther suivant tBuOMe il existe deux méthodes de synthèse :
| Cette voie de synthèse donne de mauvais rendements et seul le produit d'élimination est obtenu. |
| Cette voie de synthèse permet quant à elle de préparer convenablement, avec un bon rendement, l'éther désiré. |
Cas particulier des composés gem-dihalogénés :
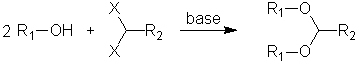
Rupture de la liaison C-O dans les éthers : la réaction marche mieux lorsqu'on utilisé HI > HBr > HCl.
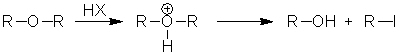
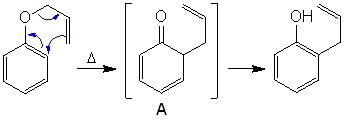
Réarrangement de Claisen : C'est une sigmatropie, c'est-à-dire la migration d'une liaison sigma le long d'un système pi. Formation de l'intermédiaire A qui est le plus stable sous la forme énol car de cette façon on retrouve un caractère aromatique.