Liaisons hydrogènes
Les alcools ont des points d'ébullitions plus élevés que les alcanes correspondants, pourquoi ?
Toute l'explication réside dans les liaisons hydrogènes. En effet pour avoir ébullition, il faut apporter l'énergie nécessaire pour que le composé passe de l'état liquide vers l'état gazeux. Mais dans le calcul de cette énergie il faut aussi compter l'énergie nécessaire à rompre les liaisons hydrogènes, l'énergie d'une telle liaison est de 5 à 6 kcal/mol (beaucoup moins que pour une liaison O-H covalente dont l'énergie est de 104kcal/mol).
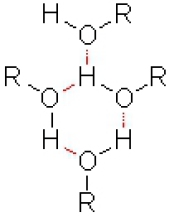
Fig. 5
Remarque :
Notons que dans les alcanes, halogèno-alcanes, ainsi que dans les éthers, ces liaisons n'existent pas et donc les points d'ébullitions sont moins élevés. Ici les liaisons hydrogènes sont représentées en rouge.





