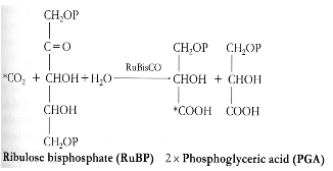
La ribulose bis-phosphate carboxylase-oxygénase
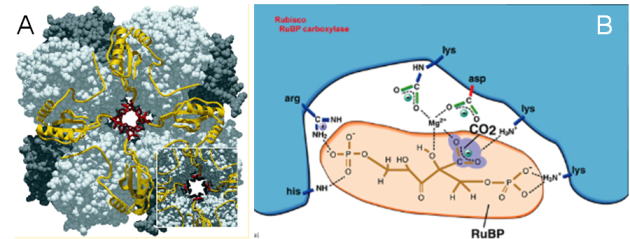
L'enzyme clef du cycle de Calvin-Benson-Bassham est la RuBisCO (EC 4.1.1.39 ; http://www.ebi.ac.uk/intenz/query?cmd=SearchID&id=10762&view=SIB) car son abondance et son efficacité déterminent la vitesse avec laquelle le CO2 est fixé par les chloroplastes et donc le taux de croissance d'une plante. La RuBisCO, qui peut représenter jusqu'à 50% des protéines totales chez les plantes, serait l'enzyme la plus abondante de la planète Terre. Etant donné son rôle central dans la production primaire, la RuBisCO est une enzyme très largement étudiée et sa structure tridimentionnelle est maintenant bien connue (Figure 46). Elle diffère légèrement entre les plantes supérieures et les algues. La RuBisCO est une grosse enzyme de 70 000 Da. Elle est formée de quatre hétérodimères (Figure 46). Chaque hétérodimère est composé d'une grande sous-unité (représentée en nuances de gris dans la figure 46) et d'une petite sous-unité (représentée en jaune et rouge dans la figure 46). Comme vous le constatez, l'enzyme présente une symétrie d'ordre 4. L'insert dans la figure 46 représente la RuBisCO de l'épinard, pour laquelle on constate de légères différences dans la petite sous-unité. Chaque hétérodimère contient du zinc, du magnésium et possède un site actif. C'est ce site actif qui est utilisé pour transformer une molécule de RuBP en 2 molécules de PGA (Figure 45).
A. Organisation globale de la RuBisCO : L'enzyme est formée de quatre hétérodimères, chacun étant composé d'une grande sous-unité (représentée en nuances de gris) et d'une petite sous-unité (représentée en jaune et rouge). La structure globale présente une symétrie d'ordre 4. L'insert dans la figure représente la RuBisCO de l'épinard, pour laquelle on constate de légères différences dans la petite sous-unité.
B. Schéma d'un site actif de la RuBisCO avec son substrat, le RuBP en place est en train d'être carboxylé.