L'expérience historique de Calvin-Benson-Bassham : principe expérimental
Comment suivre pas à pas les atomes de carbone fixés par la photosynthèse dans des cellules dans lesquelles les atomes de carbone sont légions ? Une tâche aussi difficile que de chercher une aiguille dans une botte de foin. La seule façon s' y parvenir est de marquer les atomes de carbone entrant dans le chloroplaste. Dans les années 1950, la seule méthode disponible consistant à utiliser des molécules contenant un atome radioactif. Dans le cas du carbone, l'isotope utilisé était le 14C. Si l'on permet à une plante d'absorber du CO2 marqué au 14C (14CO2), le devenir de ces atomes tout pouvait être suivi, car les molécules organiques dans lesquelles ces atomes avaient été incorporés pouvaient être distinguées de leurs semblables fabriquées à partir du CO2 non marqué à condition d'utiliser la méthode dite du “pulse-chase”. Comme son nom l'indique, il s'agit d'incuber les cellules avec les molécules marquées pendant un court moment (“pulse”) et ensuite de suivre l'évolution des atomes marqués (“chase” ou chasse). Les scientifiques de l'époque disposaient donc d'une méthode permettant d'étudier le cheminement des atomes de carbone dans le métabolisme cellulaire. Encore fallait-il être en mesure d'arrêter les réactions rapidement afin d'isoler les intermédiaires. Il était impensable d'utiliser une plante terrestre pour effectuer cette expérience car (1) il eu fallu placer les plantes dans un milieu confiné possédant l'atmosphère enrichie en 14CO2 qu'il fallait pouvoirretirer après le “pulse” et (2) le temps d'obtenir des tissus et l'extraction des composés est trop important en regard de la vitesse du métabolisme. Pour contourner les difficultés, CALVIN et ses collaborateurs, BASSHAM et BENSON (Figure 40), ont opté pour l'utilisation d'organismes photosynthétiques aquatiques de petite taille, en l'occurrence des microalgues vertes (Chlorella sp. ou Scenedesmus sp.), que l'on peut facilement alimenter en 14CO2. Celui-ci peut être fourni sous forme d'hydrogénocarbonate (H14CO3-) en solution.

A. Melvin CALVIN
B. Andrew BENSON
C. James BASSHAM
Le dispositif expérimental utilisé est présenté dans la figure 41. Les microalgues sont cultivées dans un bioréacteur transparent permettant l'illumination de la culture par de la lumière blanche. L'échauffement de la culture pendant l'expérience est évité à l'aide de filtres “anticaloriques” c'est-à-dire filtrant les rayonnements infra-rouges (Figure 41A). Le bioréacteur est équipé d'un entonnoir permettant le transfert de la culture de microalgues à utiliser, d'un tube permettant la circulation de l'air, et du CO2 et d'une sortie permettant la collecte des échantillons. La prise de l'échantillon est contrôlée par un électroaimant ouvrant et fermant rapidement l'orifice de sortie. Le métabolisme est stoppé instantanément lorsque les échantillons tombent dans un bain de méthanol chaud (“hot methanol”). La récolte des échantillons dans un un espace de temps compatible avec la durée des réactions biochimiques et l'instantanéité de l'arrêt des réactions cellulaires constituent deux qualités essentielles de cet appareillage et ont assuré le succès des expériences. Une aiguille de seringue est ajoutée au dispositif. Elle permet l'injection de la solution d'hydrogénocarbonate marqué.
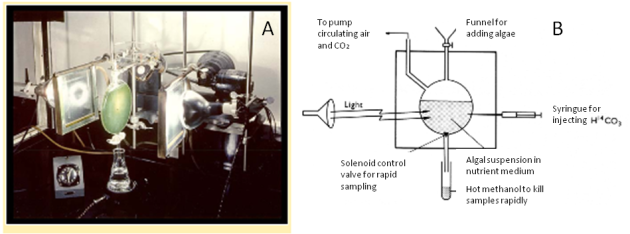
A. Photographie du dispositif expérimental.
B. Schéma explicatif du dispositif expérimental. Les microalgues (“algal suspension in nutrient suspension”) sont cultivées dans un bioréacteur transparent permettant l'illumination (“light”) de la culture. Le bioréacteur est équipé d'un entonnoir (“funnel”) permettant le transfert de la culture, d'un tube permettant la circulation de l'air et du CO2 (“to pump”) et d'une sortie permettant la collecte des échantillons. La prise de l'échantillon est contrôlée par un électroaimant ouvrant et fermant rapidement l'orifice de sortie (“solenoid control valve”). Les échantillons sont instantanément inactivés en tombant dans un bain de méthanol chaud (“hot methanol”). Une aiguille de seringue est ajoutée au dispositif. Elle permet l'injection de la solution d'hydrogénocarbonate marqué.
Une expérience typique se déroule de la manière suivante : une suspension de microalgues vertes est illuminée dans le bioréacteur. A un instant t, du 14CO2 radioactif sous la forme de H14CO3 est injecté. Après une durée précise et suffisante d'incubation (fraction de seconde jusqu'à quelques minutes selon les espèces de microalgues), une aliquote de la suspension est transférée dans 4 volumes d'alcool chaud (Calvin 1961). L'extrait alcoolique est traité de la manière suivante :
séparation des constituants par chromatographie bidimensionnelle : utilisation de deux mélanges (première direction : eau/phénol, seconde direction : butanol/acide propionique) (Figure 42A) ;
révélation du chromatogramme : utilisation de différents colorants spécifiques des molécules organiques d'intérêt (acides organiques : bleu de bromophénol, acides aminés : ninhydrine, sucres : naphtorésorcinol et composés phosphorylés : molybdate d'ammonium) ;
l'autoradiographie : la radioactivité étant invisible à l'oeil, il est nécessaire pour la localiser de recouvrir - à l'obscurité - des chromatogrammes non colorés à l'aide d'un film photographique contenant de l'halogénure d'argent. En effet, la lumière induit la précipitation de l'argent et la formation d'une image. Après un temps d'exposition, le film est révélé. Les taches sombres indiquent la présence des composés organiques contenant du carbone radioactif. La comparaison des chromatogrammes colorés et des chromatogrammes révélés par autoradiographie permet de déterminer la nature des produits synthétisés au cours de la photosynthèse en présence de 14CO2 (Figure 42B).

A. Schéma des manipulations permettant de séparer et de révéler les molécules organiques des microalgues par chromatographie bidimensionnelle.
B. Exemple de chromatogramme réalisé par TREMBLIN avec la macroalgue brune Fucus serratus.
La figure 43 compare des chromatogrammes obtenus après 5 s et 15 s d'incubation en présence d'hydrogénocarbonate marqué. Après 5 s, 3 taches correspondant à des diphosphates, des monophosphates d'hexoses (“hexose monophosphate”) et de l'acide phosphoglycérique (PGA) concentrent toute la radioactivité. La tache de PGA est la plus importante. Dix s plus tard, deux nouvelles taches sont apparues, elles correspondent aux trioses phosphate (“Triose P”) et à l'acide malique. Si l'importance de la tache de PGA n'a pas changé, les taches correspondant aux diphosphates et monophosphates d'hexoses se sont agrandies. Ceci suggère qu'au cours des 10 s qui séparent les prises d'échantillons, les microalgues ont accumulé des diphosphates et monophosphates d'hexoses. Comme de nouveaux produits sont apparus et que la surface de la tache de PGA n'a pas changé, il s'agit sans doute d'un intermédiaire central du métabolisme du carbone.
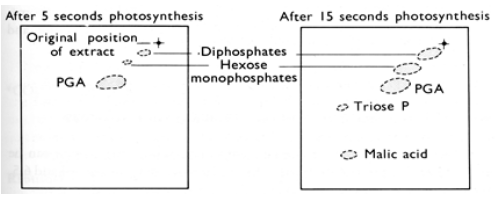
Après 5 s, 3 taches concentrent toute la radioactivité. Elles correspondent à des disphosphates, des monophosphates d'hexoses (“hexose monophosphates”) et de l'acide phosphoglycérique (PGA). La tache de PGA est la plus importante. Après 15 s d'incubation, deux nouvelles taches sont apparues, elles correspondent à des trioses phosphate (Triose P) et à l'acide malique.
La comparaison des chromatogrammes d'échantillons récoltés régulièrement pendant quelques minutes a permis à CALVIN et ses collaborateurs (Calvin 1952, Bassham et Calvin 1959) de connaître la nature et la quantité de composés carbonés formés par la photosynthèse. Ces résultats sont aujourd'hui connus sous le nom de cycle de Calvin-Benson-Bassham. Calvin a obtenu le prix Nobel en 1961 pour ces travaux. Découvrons maintenant ce cycle