4.2.2 - Exemple de l'insuline
La comparaison des proinsulines dans différentes espèces a permis de mesurer la vitesse évolutive de la protéine (fig. 4.17). Le premier constat est que les différentes parties de la protéine évoluent différemment :
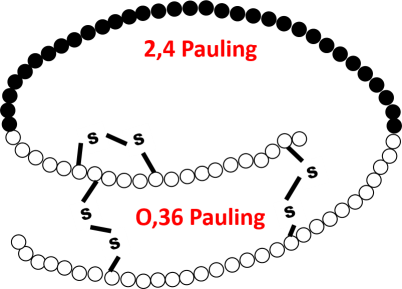
Le peptide C évolue donc 6 fois plus vite que les parties constituant l'insuline fonctionnelle.
Le lien entre le rôle des différents domaines et leur vitesse évolutive peut être fait :
le peptide C ne joue qu'un rôle structural transitoire dans la proinsuline. Dans le cadre de cette fonction, plusieurs acides aminés peuvent avoir des propriétés similaires et le remplacement de l'un d'eux par un autre aura peu ou pas d'effet.
La plupart des acides aminés des peptides A et B sont importants pour la fonction hormonale de l'insuline. Remplacer l'un d'eux modifie avec une forte probabilité la fonction.
Dans ces conditions, on peut en déduire :
qu'une mutation dans le peptide C aura une probabilité élevée d'être neutre
qu'une mutation dans les peptides A ou B aura une faible probabilité d'être neutre
Partant du constat qu'il est plus facile de déprécier une fonction que de l'améliorer, on peut en conclure que la plupart des mutations dans les peptides A et B seront délétères et donc éliminées sous l'effet de la sélection. Ainsi leur séquence sera beaucoup moins soumise au changement que celle du peptide C, plus tolérante à la modification.