Exemple de l'anémie falciforme chez l'Homme
La situation ressemble a priori à ce qui a été décrit dans le chapitre précédent. Le gène existe sous deux formes alléliques βA (allèle sauvage) et βS (allèle déficient). On peut prédire pour cette maladie génétique monogénique, autosomique récessive que l'allèle βS sera présent à une fréquence faible (± 1%) dans les populations. Si c'est effectivement le cas dans de nombreuses régions du monde, certaines populations, en particulier en Afrique centrale présentent une fréquence très élevée de l'allèle βS, parfois supérieure à 20% (fig. 3.72).
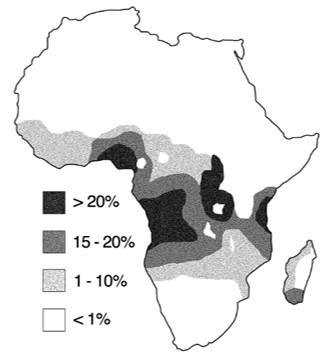
Cette situation est totalement incompatible avec la modélisation du processus de sélection envisageable. Par ailleurs les populations originaires de cette région mais déportées aux États-Unis à partir du XVIIème siècle par la traite des esclaves (noirs américains) présentent une fréquence faible de l'allèle βS.
Il a donc paru évident que la région concernée offraient des conditions particulières susceptible de modifier la nature du processus de sélection.
La solution a été suggérée par la superposition de la carte de répartition de l'allèle βS et celle de la répartition de la malaria (paludisme), une maladie infectieuse due à un parasite protozoaire, Plasmodium falciparum (fig. 3.73).
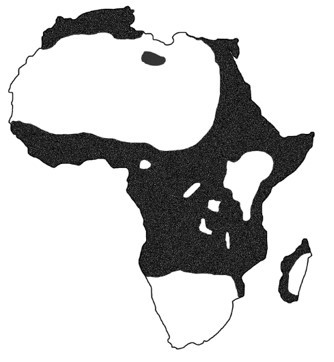
Haldane en 1949 suggère que le génotype hétérozygote βA/βS est une protection contre la malaria. Cette intuition a été testée par une étude épidémiologique réalisée entre 1950 et 1960 et rapportée par Moltusky en 1964 (fig. 3.74).
localisation de la population étudiée | nombre d'individus morts du paludisme (N) | fréquence des βA/βS dans la population totale (f) | nombre attendu de morts βA/βS (N X f) | nombre de morts βA/βS constaté |
|---|---|---|---|---|
Kinshasa (RDC) | 23 | 0,26 | 6 | 0 |
Kananga (RDC) | 21 | 0,29 | 6 | 1 |
Ibadan (Nigeria) | 27 | 0,24 | 6-7 | 0 |
Accra (Ghana) | 13 | 0,08 | 1 | 0 |
Kampala (Ouganda) | 16 | 0,19 | 3 | 0 |
bilan | 100 | 0,226 | 22 -23 | 1 |
L'analyse de ces résultats indique très clairement qu'un nombre infime des hétérozygotes succombent effectivement de la malaria : la fréquence moyenne des hétérozygotes dans les populations analysées laissait supposer qu'on en trouverait 22 ou 23 parmi les morts de la malaria mais un seul a été dénombré.
En utilisant populus, vous pourrez vérifier que des valeurs sélectives w1 = 0,88 ; w2 = 1 ; w3 = 0,13 permettent à la fréquence de l'allèle βS de s'établir autour de 0,123. Dans ces conditions, on considère que 12% des βA/βA mourront à cause de la malaria (88% de survivants), 87% des βS/βS à cause de la drépanocytose (13% de survivants) mais que les hétérozygotes sont protégés des deux affections. Il s'agit d'une sélection équilibrante par avantage de l'hétérozygote. Cet équilibre est rapidement perturbé dès que les populations sont retirées d'un contexte d'infection par la malaria. La fréquence de βS retombe alors à des valeurs faibles, proche du %. La population noir américaine en est la démonstration.