Introduction
La troisième voie de tri à partir du réseau trans-golgien conduit à la formation de vésicules qui ne fusionnent avec la membrane plasmique qu'après avoir reçu un signal qui initie la fusion. La charge protéique des vésicules résulte de mécanismes de tri que l'on pense très divers étant donné qu'aucun motif commun n'a été mis en évidence dans les protéines concernées.
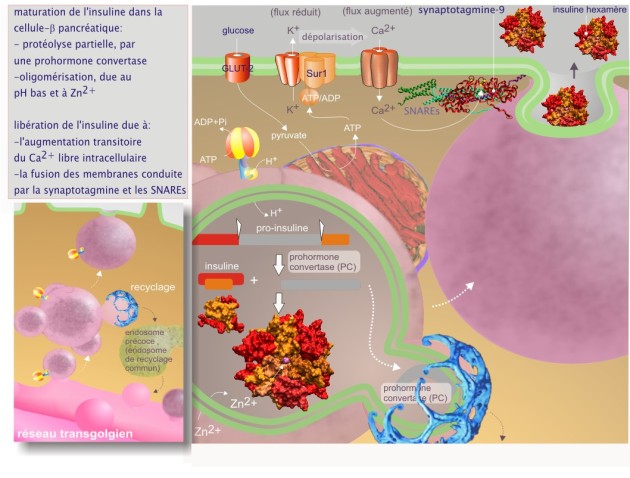
Cette voie contrôlée est très représentée dans des cellules spécialisées dans la libération rapide sur demande, de produits tels que les hormones, les enzymes digestives (produites respectivement par les glandes endocrines et exocrines) ou les neurotransmetteurs. Souvent, le contenu de ces vésicules subit une concentration, favorisée par l'addition de Zn2+ et l'abaissement du pH (par l'H+–ATPase type V), deux facteurs qui favorisent l'agrégation des protéines (voir figure 9). En microscopie électronique ce processus est matérialisé par la présence de granules de morphologie variable : grands et immatures près du réseau trans-golgien jusqu'aux granules matures, petits et denses (dénommés alors granules de sécrétion), accumulés immédiatement sous la membrane plasmique et donc prêts à fusionner avec elle. Pendant la maturation, des pro-hormones convertases (PC1 et PC2, identifiées chez les mammifères) assurent des coupures spécifiques après des motifs dibasiques (arg–arg, arg–lys, lys–arg, lys–lys). D'autres enzymes sont chargées de sulfater les oligosaccharides des glycoprotéines. Toutes ces enzymes de maturation ne seront pas sécrétées car elles auront été éliminées avant l'exocytose par bourgeonnement de vésicules tapissées de clathrine.
Le caractère tardif de ces modifications trouve des justifications variées : par exemple, 1/ la forme précurseur des enzymes digestives (les zymogènes) évite leurs effets délétères pour la cellule qui les produit ; et 2/ des peptides de petite taille, tels que les enképhalines (qui se fixent aux récepteurs opioïdes), sont trop courts pour être transportés à travers l'appareil de Golgi dans leur forme mature de pentapeptides ; 3/ les protéines doivent garder leurs peptides de destination le plus longtemps possible ( pour une illustration des modifications de la pro-insuline et de la prohormone POMC).
Modification des précurseurs protéiques dans la vésicule de sécrétion : exemple de la POMC
Les neuropeptides sont produits par coupure d'une prohormone en plusieurs séquences amino acidiques par des enzymes appelées prohormone–convertases 1 et 2 (qui coupent la chaîne polypeptidique après des paires de résidus basiques formées par la lysine (K) et l'arginine (R)). Ainsi, la protéine-précurseur POMC de 30 kDa peut potentiellement donner naissance à neuf peptides différents (i pour une illustration). En fonction du type de cellule hypophysaire, type « corticotrope » ou type « mélanotrope », ce précurseur est « converti » en ACTH, \(\gamma\)–MSH, \(\beta\)–endorphine et \(\gamma\)–LPH ou en NTP, \(\gamma\)3–MSH, \(\alpha\)–MSH, \(\beta\)–LPH et –endorphine, respectivement.