Recyclage des récepteurs MPR
De nombreux récepteurs, y compris les MPRs, s'échappent des endosomes précoces et tardifs, pour être recyclés. Pour ce qui concerne les MPRs, ils sont rassemblés dans une région bourgeonnante de l'endosome (analogue à « un site de sortie »). Dans le cas d'un endosome précoce, ceci implique l'intervention de protéines PACS–1 et AP–1, qui provoquent la formation d'une vésicule tapissée de clathrine. Dans le cas d'un endosome tardif, le processus requiert la présence de protéines cytosoliques TIP47 et Rab9 liant le GTP.
![]() Pour tout savoir sur les nombreux peptides de destination portés par le récepteur du mannose–6–phosphate, consultez le document suivant : « mannose-P Receptor review Ghosh-Kornfeld » [pdf] (2158 Ko).
Pour tout savoir sur les nombreux peptides de destination portés par le récepteur du mannose–6–phosphate, consultez le document suivant : « mannose-P Receptor review Ghosh-Kornfeld » [pdf] (2158 Ko).
Complément : Excursion : le récepteur du mannose–6–phosphate CI–MPR régule la prolifération et la motilité cellulaire
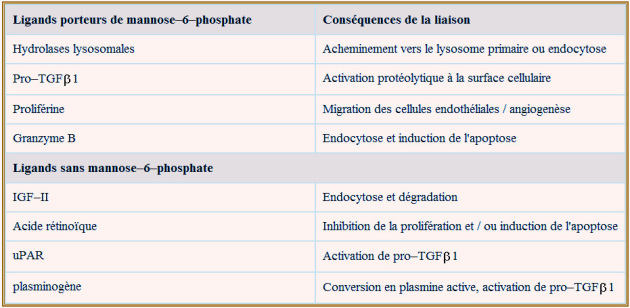
Certains CI-MPR (à peu près 10%) se retrouvent dans la membrane cytoplasmique, probablement parce qu'ils ont échappé aux protéines GGAs lors du tri au niveau des citernes trans-golgiennes ou qu'ils sont recyclés en provenance de l'endosome. Leur rôle devient apparent lorsqu'on sait que leur absence, chez la souris mutante (homozygote récessive ou knock-out), se traduit par l'hypertrophie des organes (le cœur en particulier) associée à des niveaux circulants très élevés d'IGFII. Chez ces animaux, l'absence provoquée de récepteur à l'IGFII, rétablit la normalité. De ceci, il ressort que CI–MPR joue un rôle important dans la clearance de l'IGFII tissulaire, réduisant ainsi son signal de croissance. Des travaux récents ont montré que CI–MPR intervient dans l'activation d'un facteur d'inhibition de la prolifération cellulaire, le TGF\(\beta\)1. Cet inhibiteur nécessite une activation par protéolyse partielle qui fait appel à la plasmine, protéase qui à son tour est activée par uPAR en présence de CI–MPR.