Vers la voie de sécrétion constitutive
La sécrétion constitutive est une activité exercée par la plupart des cellules dans le but de fournir la membrane en lipides et protéines et de maintenir la matrice extracellulaire (collagène, fibronectine, laminine, protéoglycanes et aussi protéases responsables du remaniement de la matrice). Toutes ces substances synthétisées par la cellule sont insérées dans la membrane plasmique ou libérées dans l'environnement par le processus dit d'exocytose, fusion d'une vésicule de sécrétion avec la membrane plasmique. On ne sait pas encore exactement comment la charge qui subit ce transport constitutif est sélectionnée. Les vésicules de transport de la voie constitutive sont pourvues de la machinerie nécessaire à la fusion à la membrane plasmique : les Q–SNAREs Syntaxine–4 (liée à Munc18b/c), SNAP–23 (N–terminal), SNAP–23 (C–terminal), la R–SNARE cellubrévine et plusieurs GTPases de la famille Rab (dans laquelle Rab3a est dominante).
Dans les cellules épithéliales, où la jonction serrée délimite un domaine apical et un domaine basolatéral, la distribution des protéines membranaires ne peut pas se faire au hasard. Deux stratégies au moins semblent impliquées : une voie dite directe (sélection au niveau du réseau trans-golgien) et une autre dite indirecte (sélection par l'intermédiaire de l'endosome) (voir figure 7).
pour plus de détail sur la cavéoline.
Dans la voie directe, la destination « basolatérale » est signalée par la présence d'un motif amino acidique, tyrosine (Y) ou di-leucine (LL), ainsi que cela a été démontré pour le récepteur des lipoprotéines de faible densité (R–LDL), pour le récepteur de la transferrine (qui permet l'apport de fer à la cellule), pour le récepteur du mannose–6–phosphate (CI–MPR) et pour le récepteur des immunoglobulines polymériques (nécessaire à la sécrétion des IgA et IgM dans le mucus). Le complexe AP4 intervient dans la sélection de ce motif et les vésicules bourgeonnent sans intervention de la clathrine (cas unique pour le complexe AP4).
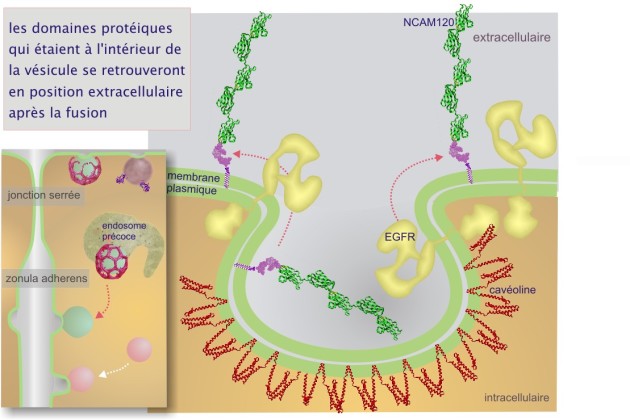
La destination « apicale » est signalée par la présence de l'ancre membranaire glycosylphosphatidylinositol (GPI) et le domaine de liaison de la cavéoline \(\phi\)X\(\phi\)XXXX\(\phi\) (ou \(\phi\) est un acide aminé aromatique tel que le tryptophane (W), la phénylalanine (P) ou la tyrosine (Y)). Certains récepteurs et des protéines membranaires intrinsèques sont apportés à la membrane plasmique par un tel mécanisme. Des exemples concernent le récepteur de l'insuline, des récepteurs de facteurs de croissance tels que PDGF et EGF et la protéine G hétérotrimérique. Ces protéines seront traitées dans une ressource ultérieure sur la « signalisation cellulaire ». En effet, la plupart des protéines qui les possèdent aboutissent dans les vésicules trans-golgiennes, destinées à la membrane plasmique apicale, riches en sphingomyéline, cholestérol (composants de radeaux lipidiques) et cavéoline–1 (protéine de poids moléculaire 21 kDa) (cliquez sur la loupe de la figure 33). La cavéoline existe sous plusieurs formes appelées cavéoline–1, 2 et 3. L'expression de cavéoline–3 est limitée aux cellules musculaires.
La voie indirecte résulte d'abord dans la distribution aléatoire des protéines membranaires puis dans leur endocytose suivie par leur redistribution sélective (basolatérale ou apicale) à partir de l'endosome précoce (aussi connu comme « endosome de recyclage »). La sélection dans l'endosome précoce est réalisée par la protéine du manteau AP–1B (ainsi nommée pour la présence de la chaîne \(\mu\) type 1B). La charge sélectionnée est prélevée par une vésicule tapissée de clathrine qui s'achemine vers la membrane basolatérale et s'associe avec elle grâce à la présence d'un complexe protéique (poids moléculaire de 743 kDa) appelé exocyste (localisé près de la zonula adherens). L'exocyste, ou complexe Sec6/8, est constitué de huit protéines, Sec3, 5, 6, 8, 10, 15, 70 et 84, associées avec les Q–SNAREs de la famille de la syntaxine et de SNAP. L'interaction initiale entre vésicule de sécrétion et exocyste est réalisée par la liaison de la GTPase Rab11 (état GTP) avec Sec15.
Les protéines endocytées mais non sélectionnées par AP–1B, quittent aussi l'endosome précoce par bourgeonnement d'une vésicule qui, cette fois, se dirige vers la membrane apicale.
Dans la figure 8, nous montrons que les protéines (ou domaines protéiques) qui étaient à l'intérieur de REr, Golgi ou des vésicules de transport, se retrouveront à l'extérieur de la cellule après la fusion avec la membrane plasmique.