le complexe catalytique (20 S)
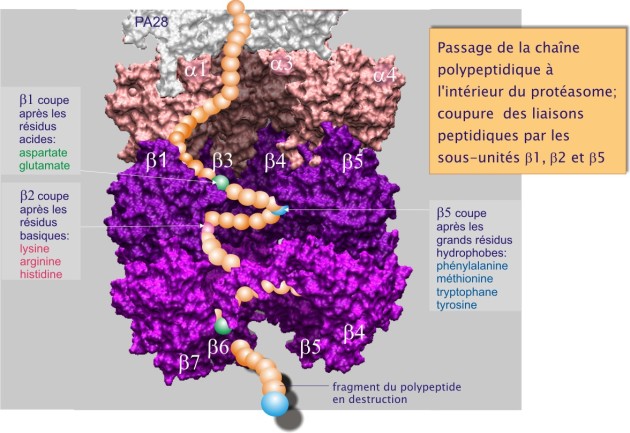
La particule 20 S est très bien conservée dans l'échelle phylogénétique, puisqu'on la trouve aussi bien chez les archae bactéries et les levures que chez les mammifères. Le protéasome, présent en plusieurs exemplaires dans le cytoplasme et le nucléoplasme, a la forme d'un cylindre (dimensions de 15 nm de longueur sur 11 nm de diamètre) composé de 28 sous-unités : deux exemplaires d'\(\alpha\)1 à \(\alpha\)7 et de \(\beta\)1 à \(\beta\)7 (). L'activité protéolytique se situe à l'intérieur du cylindre sur trois différentes sous-unités , chacune ciblant un site précis de coupure : après des résidus acides pour \(\beta\)1 (caspase-like), après des résidus basiques pour \(\beta\)2 (trypsin-like) et après des résidus hydrophobes pour \(\beta\)5 (chymotrypsin-like) (voir figure 23 et pour voir son deuxième plan). L'ensemble permet la dégradation d'une large gamme de protéines. Les sous-unités \(\beta\)3, 4, 6, et 7 ne portent pas d'activité catalytique.