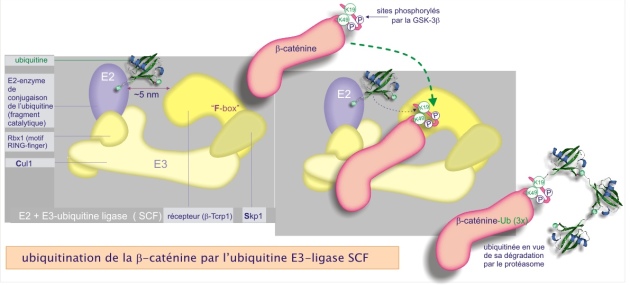
Ubiquitination par l'E3–ligase (SCF)
Un exemple d'une E3–ligase du groupe 2, composée de plusieurs sous-unités dont l'une possède un motif RING-finger, est la SCF (Skp1–Cullin1–F–box protein). Son rôle est particulièrement bien étudié dans le contexte de la prolifération cellulaire (cycle de division). Nous illustrons ici en détail l'ubiquitination de la \(\beta\)–caténine, un composant du cytosquelette, déjà évoqué dans la ressource « molécules d'adhérence [pdf] ». La figure 21 montre la composition de la SCF E3–ligase et la chaîne des événements aboutissant à l'ubiquitination de la \(\beta\)–caténine. Elle est d'abord phosphorylée sur plusieurs résidus de sa portion N–terminale appartenant à une séquence d'acides aminés qui constitue un « motif de destruction ». La phospho–\(\beta\)–caténine se fixe ensuite sur le récepteur Trcp qui appartient au complexe E3 ligase et dont le rôle est de présenter le site d'ubiquitination à l'E2–conjugating enzyme (distance minimum requise de 0,3 nm). L'E2 transfère son ubiquitine sur un résidu lysine de la \(\beta\)–caténine (K19 ou K29).
Complément : Prix Nobel pour la découverte du système d'ubiquitination
En 1980, Avram Hershko et Aaron Ciechanover en collaboration avec Irwin Rose démontrèrent qu'une chaîne polypeptidique thermostable, alors appelée facteur protéolytique–1 ATP dépendant, pouvait être conjuguée aux protéines (uniquement en présence d'ATP), qui par cet événement étaient désignées pour la dégradation. Plus tard, ce facteur fut assimilé à une petite protéine de 76 acides aminés déjà identifiée par Goldstein et ses collègues sous le terme d'ubiquitine (en raison de son expression ubiquitaire). La cascade enzymatique de conjugaison entre l'ubiquitine et une protéine a été élucidée en 1983, comme précédemment décrit (dans le paragraphe Ubiquitination par l'E3–ligase SCF).
Peu après, dans un travail piloté par Alexander Varshavsky et Daniel Finley, et grâce à ts85, mutant thermosensible de l'enzyme E1 exprimé dans une lignée cellulaire murine (à une température non permissive), montrèrent que la perte de l'activité E1 coïncidait avec l'absence de dégradation des protéines à courte demi-vie. Cela démontra pour la première fois que l'ubiquitine était nécessaire à la dégradation protéique.
Les travaux de Ciechanover, Hershko et Rose ont été couronnés par le prix Nobel de Chimie 2004 « pour la découverte de la dégradation protéique induite par l'ubiquitine ».
Les travaux de Ciechanover, Herskhko et Rose ont été couronnés par le prix Nobel de Chimie 2004 « pour la découverte de la dégradation protéique induite par l'ubiquitine ». Pour plus d'information sur ces laureates du Prix Nobel cliquez ici http://www.nobelprize.org/nobel_prizes/chemistry/laureates/2004/