7.4 Dégradation des protéines par les caspases (apoptose)
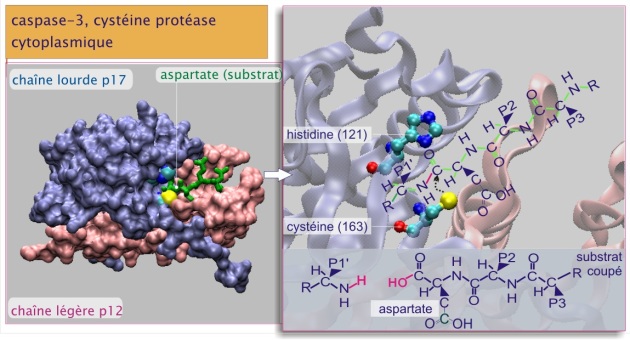
Les cellules sont pourvues d'un autre type de protéases, surtout cytoplasmiques cette fois, appelées caspases. Elles sont impliquées dans l'exécution de la réponse inflammatoire et particulièrement dans l'application de la « peine de mort » cellulaire, appelée mort cellulaire programmée type I ou apoptose. Les caspases sont ainsi nommées car : a/ le résidu catalytique est une cystéine (comme c'est le cas de la protéase papaïne), b/ elles coupent leurs substrats après un résidu aspartate et c/ ce sont des protéases (voir figure 27). Le génome humain code 11 caspases, classées en quatre groupes selon l'organisation de leurs domaines (voir tableau 1 ci-dessous). En raison de leur sélectivité, les caspases ne causent pas une très large dégradation protéique : en effet, seuls 280 substrats ont été reconnus à ce jour. L'élimination de ces protéines induit les changements morphologiques caractéristiques qui accompagnent la mort cellulaire.

Selon le mécanisme qui les active et leur place dans la cascade des événements, les caspases se répartissent en deux groupes :
Caspases initiatrices (2, 8, 9, 10), activées par dimérisation ou trimérisation. Dans la ressource « la mitochondrie [pdf] », nous avons déjà vu que le cytochrome c joue un rôle très important dans l'activation des pro-caspases initiatrices. En effet, le cytochrome c regroupe en un même complexe 6 caspases (type caspase–8), facilitant ainsi dimérisation et activation (voie d'activation intrinsèque). La formation de trimères de caspase–9 est réalisée lors de la fixation de cette caspase au trois récepteurs de la cytokine TNF-\( \alpha\) regroupés par leur ligand (voie d'activation extrinsèque). Les caspases initiatrices sont souvent clivées, mais cette coupure n'est pas nécessaire à l'expression de leur activité. Les substrats des caspases initiatrices sont les caspases effectrices.
Caspases effectrices (3, 6 et 7) activées par protéolyse. Elles sont synthétisées sous forme inactive, pro-caspases effectrices, dans lesquelles le site catalytique est masqué à l'intérieur de la protéine. Au contraire des caspases initiatrices, leur activation requiert une coupure de la protéine après un résidu aspartate (voir figure 27, ), autrement dit une protéolyse partielle. Cette coupure est réalisée par des caspases initiatrices.
La mort cellulaire induite par les caspases n'alerte pas le système immunitaire. En effet, les débris cellulaires sont éliminés par les cellules voisines ou par les phagocytes spécialisés tels que macrophages et neutrophiles. Après phagocytose, les débris sont traités par les enzymes lysosomales. L'apoptose joue un rôle crucial dans la régulation du renouvellement cellulaire et donc indirectement dans la régulation du renouvellement des protéines. Pour illustrer l'importance quantitative du processus, on peut citer l'exemple du lymphome à cellules B. Cette leucémie (augmentation du nombre des globules blancs dans le sang) est la conséquence de la surexpression de la Bcl–2, une des protéines qui protègent la cellule contre l'apoptose.
![]() Pour en savoir plus : un article de revue sur les caspases (apoptose)
Pour en savoir plus : un article de revue sur les caspases (apoptose)