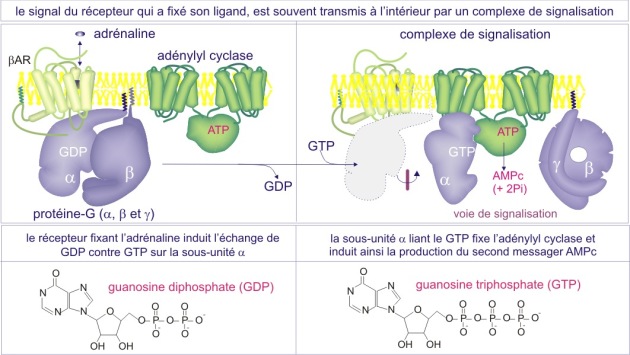
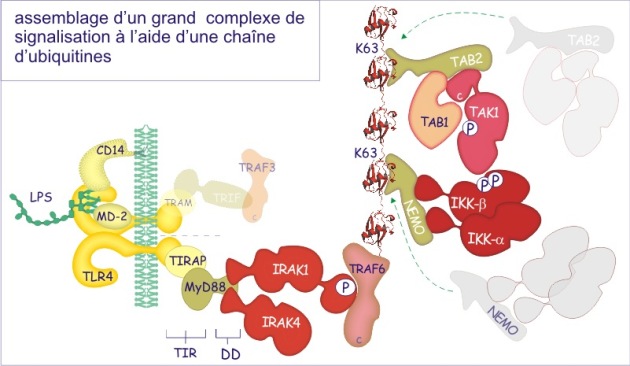
Formation d'un complexe de signalisation
Un des événements clé de la signalisation cellulaire est le recrutement des complexes de protéines autour des récepteurs liés à leurs ligands. Ces complexes assurent la conduction du signal vers l'intérieur de la cellule ; ils sont constitués de protéines dites effectrices. Deux stratégies principales gouvernent la formation de complexes de signalisation:
L'une consiste en un transfert de phosphate sur l'une des protéines (ou l'un des lipides), c'est la phosphorylation, réaction catalysée par une protéine kinase
L'autre consiste en un échange de GDP par GTP sur l'une des protéines, réaction catalysée par un facteur d'échange de guanine nucléotides (GEF).
De façon remarquable, dans les deux cas la stratégie utilisée pour altérer la conformation protéique consiste en l'addition de phosphate inorganique. On dit que la phosphorylation ou la liaison de GTP, « active » les protéines (dans certain cas cependant, la phosphorylation peut les « inactiver »), mais il est important de comprendre que cette « activation » n'est pas toujours synonyme de l'activité enzymatique ; cela peut aussi signifier « obtenir la capacité d'interagir avec d'autres protéines »(voir figures 11A et 11B).
Dans la plupart des cas, c'est le recrutement de protéines qui déclenche la suite des événements ; il rapproche substrats et enzymes ou enzymes et leurs co-facteurs. Les réactions qui s'ensuivent conduisent le signal vers l'intérieur.
Remarque : D'autres stratégies pour assembler les complexes de signalisation
Pour rassembler les protéines en complexes de signalisation la cellule peut également utiliser la modification par ubiquitination. Pour cela, une ou plusieurs ubiquitines (formant une chaîne) sont ajoutées à une protéine donnée qui sert de point d'ancrage à d'autres protéines. Dans ce cas particulier les ubiquitines sont associées entre elles par des liaisons entre glycine C-terminale et lysine-63. Ce mode de liaison n'est pas reconnu par le protéasome [pdf] et donc n'amène pas la protéine vers sa destruction.
Quelquefois, l'oligomérisation des récepteurs suffit à engendrer des interactions avec des protéines adaptatrices, qui à leur tour sont liées aux protéines effectrices (exemple, le récepteur de TNF\(\alpha\) (tumor necrosis factor\(-\alpha\))).
Ces deux modes d'assemblage (voir figure 12) ne sont pas traités dans cette ressource.
![]() Pour en savoir plus sur l'association des protéines au récepteur d'EGF étudié par une approche utilisants les « proteins microarrays », voir : « ERBB protein network McBeath [pdf] » (1 Mo).
Pour en savoir plus sur l'association des protéines au récepteur d'EGF étudié par une approche utilisants les « proteins microarrays », voir : « ERBB protein network McBeath [pdf] » (1 Mo).
![]() Pour en savoir plus sur le mode de signalisation du récepteur de TNF-a : « TNF-a signalling Aggarwal [pdf] » (1 Mo).
Pour en savoir plus sur le mode de signalisation du récepteur de TNF-a : « TNF-a signalling Aggarwal [pdf] » (1 Mo).