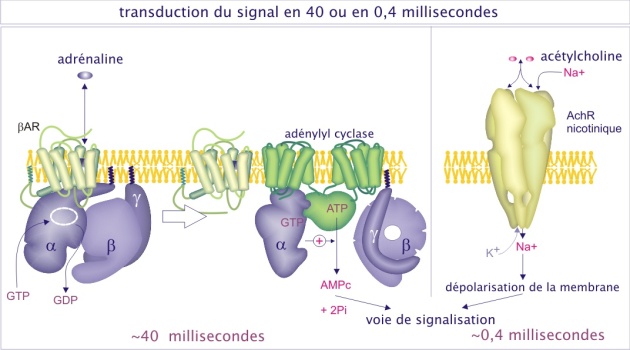
Perturbation de l'homéostasie cellulaire ; exemple classique de l'adrénaline
Le premier messager interagit avec son récepteur et cette interaction induit un « signal », par une voie de signalisation intracellulaire, qui modifie le comportement de la cellule cible. Ces voies de signalisation intracellulaires sont extrêmement diverses, parfois très courtes (ouverture des canaux ioniques) parfois en longues cascades d'interactions protéiques impliquant la production, par des molécules effectrices, de substances qui diffusent dans la cellule (ou sa membrane) et qu'on qualifie de « seconds messagers » (voir figure 7). Ces voies de signalisation ont pour but de perturber l'homéostasie cellulaire et d'imposer un changement pour ajuster l'activité de la cellule aux besoins de l'organisme entier. Les réponses cellulaires sont souvent composées d'une réponse immédiate et de courte durée, de l'ordre de quelques secondes à quelques minutes, puis d'une réponse à long terme, de l'ordre de quelques heures à quelques jours, qui passe par le noyau pour agir sur le transcriptome (plasticité cellulaire).
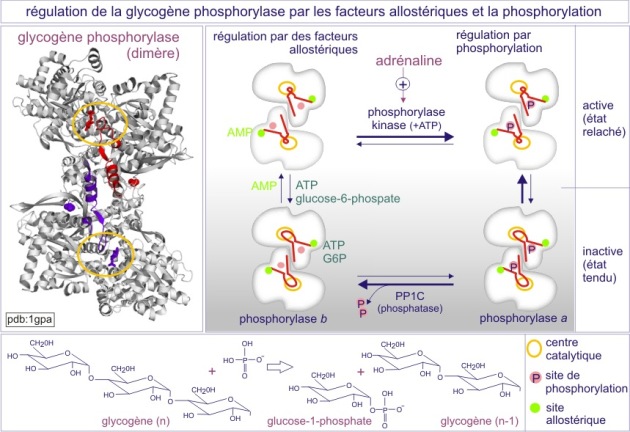
L'intervention de l'adrénaline dans la dégradation du glycogène en glucose-1-phosphate, par l'enzyme glycogène-phosphorylase du muscle squelettique, est un exemple classique de la façon dont un premier messager intervient dans la vie « quotidienne » de la cellule. En simplifiant, on peut dire que, sans intervention extérieure, l'activité de la phosphorylase-b est déterminée par quatre facteurs :
la concentration du substrat
celle du produit final,
la présence de facteurs allostériques qui interagissent positivement et
ceux qui interagissent négativement.
Le glycogène est le substrat de la glycogène-phosphorylase auquel elle arrache des glucoses qu'elle phosphoryle (glucose-1-phosphate). Le glucose-1-phosphate est converti en glucose-6-phosphate qui sert de substrat pour la glycolyse et donc la production d'ATP. Un excès de glucose-6-phosphate et un manque de glycogène inhibent l'enzyme et à l'inverse un excès de glycogène et un manque de glucose-6-P l'activent. Une concentration faible de glucose-6-phosphate se traduit par une augmentation de l'AMP qui sert de marqueur du manque d'ATP intracellulaire (car produit dans la réaction 2ADP ->AMP + ATP pour garder un bon niveau d'ATP). L'AMP, qui n'est ni substrat ni produit, stimule l'activité de la glycogène-phosphorylase et pour cela est qualifié de facteur allostérique positif. Le glucose-6-P et l'ATP, indicateurs de « plénitude », inhibent l'enzyme. Par cette régulation la cellule est capable de bien gérer la production d'ATP (homéostasie).
Remarque :
L'adjectif allostérique vient d'allo stéréos, ce qui signifie «autre solide» ou «solide différent». Le premier “solide” est un ligand (hormone, neurotransmetteur, etc) d'un récepteur ou un substrat d'une enzyme. Le deuxième “solide” est une autre molécule qui interagit à un site différent du site de liaison au ligand ou du site catalytique. Dans le cas de la glycogène phosphorylase, des exemples d'autres “solides” sont le glucose-6-phosphate (produit final) et l'AMP (indicateur d'un manque d'ATP). Leur liaison modifie la conformation de l'enzyme, et par conséquent son activité, et nous parlons de régulation allostérique. L'AMP stimule et le glucose-6-phosphate inhibe l'enzyme. La régulation allostérique est donc intimement associée aux boucles de contrôle. La notion de régulation allostérique a été proposée par Monod et collaborateurs et a fait l'objet de très nombreuses illustrations après la publication de l'article « Allosteric proteins and cellular control systems » (Monod J, Jacob F et Changeux JP. J Mol Biol 1963; 6: 306-329). Le terme allostérie est aujourd'hui le plus souvent utilisé pour définir le processus dans lequel l'interaction macromoléculaire (souvent protéine-protéine) à un endroit conduit à des changements conformationnels et fonctionnels à un autre endroit (dans l'une ou les deux macromolécules) (Motlah HN, Wrabl JO, Li J, Hilser VJ. The ensemble nature of allostery. Nature 2014 :508 ;331-339). Avec le temps "autre solide" est devenu synonyme d' "autre forme" car avec l'explosion de l'analyse de la structure, il est devenu évident que les changements conformationnels, aussi minimes soient-ils parfois, sont à l'origine de la régulation fonctionnelle des macromolécules.
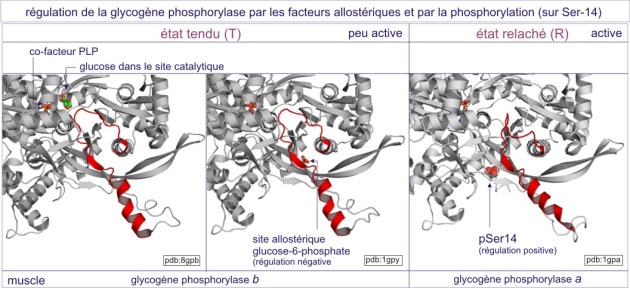
Cependant, dans certaines situations, le glucose-6-phosphate doit être produit en excès, en anticipant sur une activité musculaire extrême comme, par exemple, dans le cas de la situation “fear, fight or flight” (frayeur, lutte ou fuite). L'adrénaline, « hormone de stress », est alors mise en jeu. Elle prépare nos cellules à une consommation anticipée d'ATP. L'adrénaline se fixe à son récepteur et, par une voie de signalisation, induit une modification allostérique de la glycogène-phosphorylase (par ajout d'un phosphate lié d'une façon covalente), qui se convertit en glycogène-phosphorylase très active (état « relaxé », aussi appelé « phosphorylase-a »). Cet état est moins sensible au glucose-6-phosphate ou à l'ATP (voir figure 9). L'homéostasie est donc perturbée car la glycogène-phosphorylase-a dégrade beaucoup plus de glycogène en glucose-1-phosphate.
Remarque : Régulation de la glycogène-phoshorylase
Régulation de la phoshorylase
La nature des sites de liaison sur l'enzyme, du glycogène (substrat), du phosphate et du glucose-6-phosphate, est bien préservée dans l'échelle du vivant (de la Pomme de terre à l'Homme). En matière de régulation, l'inhibition par le glucose-6-phosphate est plus ou moins conservée mais la régulation par des nucléotides (AMP et ATP) fait défaut chez la levure et le Dictyostélium (slime mould) alors qu'elle persiste chez la Drosophile. De plus, la modification covalente par un phosphate, induite par l'adrénaline, paraît spécifique des phosphorylases mammaliennes, ce qui autorise à penser que la pluricellularité pourrait être associée à une augmentation des possibilités de régulation de l'enzyme.