7.1.2 L'azote
L'atome d'azote à une géométrie de type tétraédrique (c'est un atome hybridé sp3). L'azote peut former quatre liaisons (voir les ions ammoniums quaternaires).
Ainsi, si les trois groupes présents sur l'atome d'azote, sont différents, alors d'après les règles de Cahn - Ingold - Prelog (en comptant le doublet libre comme dernier groupe), on peut établir une configuration R ou S pour ce centre azoté.
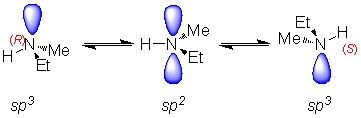
Le problème avec l'azote, c'est qu'il existe un effet connu sous le nom "d'effet parapluie". Il y a alors une inversion de configuration par changement d'état d'hybridation (sp3 →sp2 →sp3). Cette inversion est telle qu'elle a lieu plus de 1000 fois par seconde, ce qui empêche toute chiralité. Il n'en reste pas moins que le centre azoté est asymétrique, puisque ses quatre substituants sont différents.
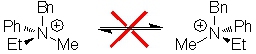
Pour les ions ammoniums quaternaires, il en est autrement, en effet il n'existe pas de mécanisme qui permette de passer d'un énantiomère à l'autre :
Comme avec les alcools, pour les amines on remarque la présence de liaisons hydrogène. La conséquence directe de cette liaison est une augmentation de la température d'ébullition d'une amine par rapport à l'alcane.