Réaction d'une base sur l'eau
On dissout 80 mg de soude
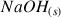 dans une fiole jaugée de 200 mL complétée avec de l'eau.
dans une fiole jaugée de 200 mL complétée avec de l'eau.
Données :
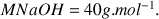 Couple méthylammonium/méthylamine
Couple méthylammonium/méthylamine
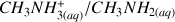 .
.
Question
Calculer le pH de la solution préparée.
D'après le cours
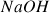 est une base forte qui se dissocie totalement dans l'eau. C'est le cas de tous les hydroxydes de métaux alcalins (
est une base forte qui se dissocie totalement dans l'eau. C'est le cas de tous les hydroxydes de métaux alcalins (
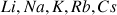 ) ou alcalino-terreux (
) ou alcalino-terreux (
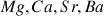 ).
).
La réaction de dissolution de la soude dans l'eau est :
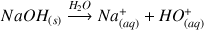
D'après l'équation de la réaction le nombre de mole final de
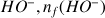 , est égal au nombre de mole initial de
, est égal au nombre de mole initial de
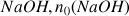 :
:
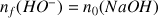 avec
avec
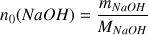
A.N.
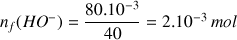
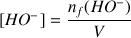 A.N.
A.N.
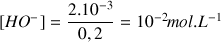
- On détermine
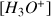 à partir de la relation :
à partir de la relation :
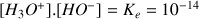 produit ionique de l'eau
produit ionique de l'eau
Donc
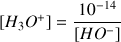
A.N.
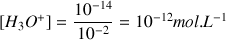
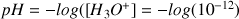
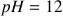
Question
On prépare 100 mL d'une solution aqueuse de méthylamine CH3NH2 de concentration en soluté apporté
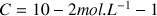 . Le pH de cette solution est égal à 11,30 à 25°C.
. Le pH de cette solution est égal à 11,30 à 25°C.
a) Écrire l'équation chimique de la réaction entre la méthylamine et l'eau.
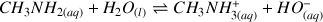
Le couple mis en jeu est
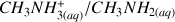 (voir données) et la méthylamine est une base.
(voir données) et la méthylamine est une base.
Question
b) Établir le tableau d'avancement ainsi que l'avancement final du système.
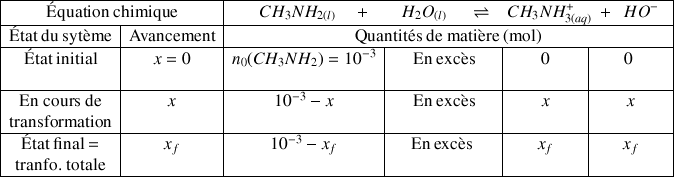
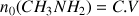 A.N.
A.N.
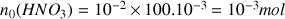
Avancement final déduit de la valeur du pH :
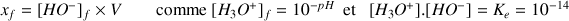
alors
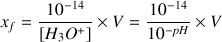
A.N.
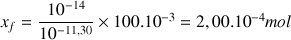
Question
c) Quelle est la valeur du taux d'avancement ? En conclure sur la force de la base méthylamine.
Avancement maximal en considérant la méthylamine comme réactif limitant :
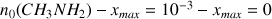 donc
donc
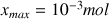
Le taux d'avancement est
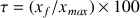
A.N.
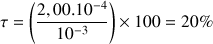
Le taux d'avancement est inférieur à 100 %. La méthylamine est une base faible car la réaction de cette base avec l'eau n'est pas totale.






