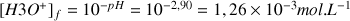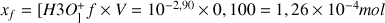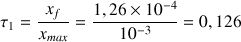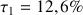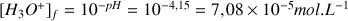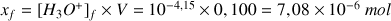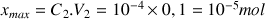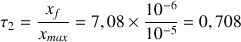Réaction acide faible avec l'eau
On va étudier l'avancement de la réaction de l'acide formique
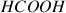 (acide méthanoïque) avec l'eau pour deux concentration apportée en acide formiques,
(acide méthanoïque) avec l'eau pour deux concentration apportée en acide formiques,
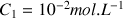 et
et
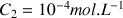 . La réaction étudiée est la suivante :
. La réaction étudiée est la suivante :
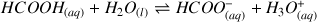
Données :
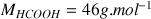 . Couple acide formique / ion formiate :
. Couple acide formique / ion formiate :
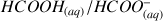 . La densité de la solution mère d'acide formique (composée à 100% d'acide méthanoïque) est
. La densité de la solution mère d'acide formique (composée à 100% d'acide méthanoïque) est
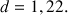
Question
Le pH d'une solution aqueuse S1 de concentration apportée en acide méthanoïque
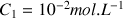 est égal à 2,90. Le volume de solution
est égal à 2,90. Le volume de solution
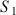 utilisé pour la mesure est
utilisé pour la mesure est
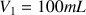 .
.
a) Quel volume d'une solution commerciale d'acide méthanoïque (solution à 100% d'acide) faut-il prélever pour préparer la solution dans une fiole jaugée de
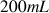 ?
?
a) Solution commerciale d'acide méthanoïque de densité
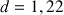 (voir données). Donc
(voir données). Donc
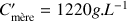 et
et
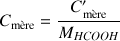
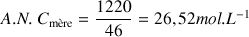
Solution fille :
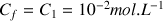 et
et
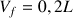
Dilution
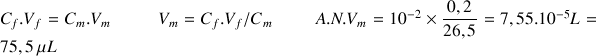
Il faut donc prélever un volume de
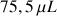 de solution commerciale d'acide formique (on utilisera une micropipette).
de solution commerciale d'acide formique (on utilisera une micropipette).
Question
Établir le tableau d'avancement de la réaction.
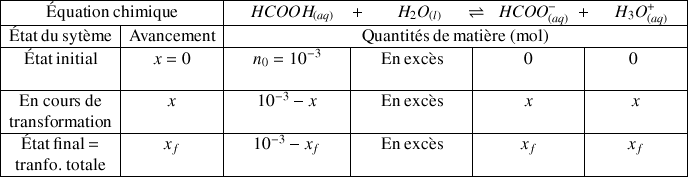
Nombre initial d'acide méthanoïque
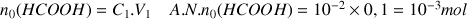
Question
c) Calculer l'avancement final de la réaction.
Question
d) La réaction est-elle totale ? On calculera l'avancement maximal de la réaction en considérant qu'elle est totale.
Si la réaction est totale tout l'acide méthanoïque est consommé avec :

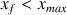 donc la réaction n'est pas totale.
donc la réaction n'est pas totale.
Question
e) Calculer le taux d'avancement
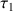 de la réaction.
de la réaction.
Question
f) Calculer les concentrations des espèces présentes à la fin de la réaction. En déduire la valeur du
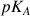 du couple
du couple
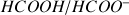 .
.
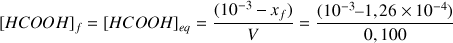
d'où
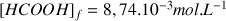
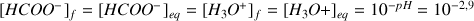
d'où
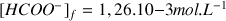
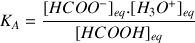
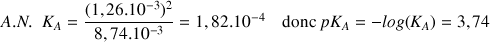
Question
Le pH d'une solution aqueuse
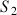 de concentration apportée en acide méthanoïque
de concentration apportée en acide méthanoïque
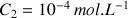 est égal à 4,15. Le volume de solution
est égal à 4,15. Le volume de solution
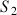 utilisée pour la mesure est
utilisée pour la mesure est
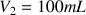 .
.
a) Calculer l'avancement final de la réaction.
Question
b) Calculer le taux d'avancement
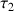 de la réaction.
de la réaction.
Question
Comparer les deux valeurs des taux d'avancement observés pour les solutions
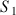 et
et
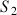 . Conclure.
. Conclure.
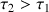 Plus un acide faible est dilué et plus il est dissocié, c'est à dire que l'équilibre de la réaction de l'acide avec l'eau se déplace dans le sens direct.
Plus un acide faible est dilué et plus il est dissocié, c'est à dire que l'équilibre de la réaction de l'acide avec l'eau se déplace dans le sens direct.