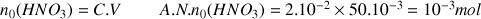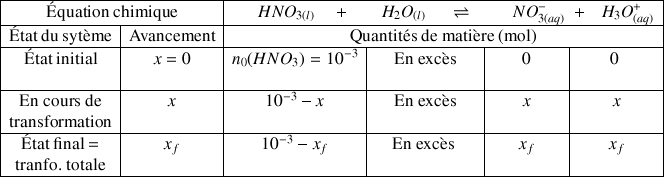Réaction d'un acide avec l'eau
On va étudier l'avancement de la réaction de l'acide nitrique
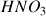 avec l'eau pour une solution S de volume V = 50 mL et de concentration apportée en acide
avec l'eau pour une solution S de volume V = 50 mL et de concentration apportée en acide
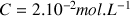 . Le pH de la solution S est égal à 1,70.
. Le pH de la solution S est égal à 1,70.
Question
a) Écrire la réaction acido-basique attendue entre l'acide nitrique
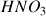 et l'eau. Quels sont les couples acide/base mis en jeu ?
et l'eau. Quels sont les couples acide/base mis en jeu ?
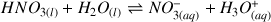
Couples mis en jeu :
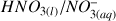 et
et
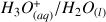
Réaction de l'acide
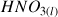 du couple
du couple
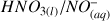 avec la base
avec la base
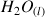 du couple
du couple
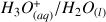 .
.
Question
b) Établir le tableau d'avancement de la réaction.
Question
c) Calculer l'avancement final et maximal de la réaction. Conclure sur la force de l'acide.
Avancement final déduit de la valeur du pH :
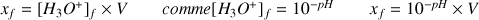
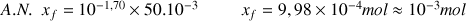
Avancement maximal en considérant l'acide nitrique comme réactif limitant :
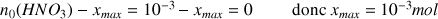
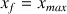 donc la réaction est totale. Le taux d'avancement est égal à 100 % (
donc la réaction est totale. Le taux d'avancement est égal à 100 % (
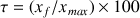 ). L'acide nitrique est un acide fort, il se dissocie totalement dans l'eau. L'acide nitrique a été cité dans les exemples d'acides forts dans le cours.
). L'acide nitrique est un acide fort, il se dissocie totalement dans l'eau. L'acide nitrique a été cité dans les exemples d'acides forts dans le cours.