Une modification spécifique : la formation de mannose–6–phosphate, « glucide de destination » des enzymes lysosomiques
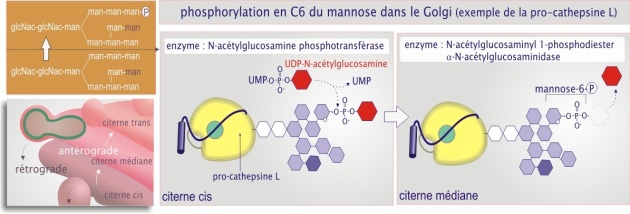
Par un exemple précis, la glycosylation de la protéase cathepsine L [pdf] (38 kDa sans glucides), nous documentons ci-après la modification particulière de la cupule glucidique, spécifique aux enzymes à destination du lysosome : la C6–phosphorylation du mannose.
La cathepsine quitte le REr sous forme de pro-enzyme, la pro-cathepsine, portant la cupule de N–glycosylation sur l'asparagine–221. Dans le cis-Golgi, un mannose de la branche interne est enlevé par la mannosidase type–2. La protéine est ensuite reconnue, problablement grâce à la présence de deux lysines situées en position 54 et 99 (pour la pro-cathepsine L murine), par la N–acétylglucosamine–1 phosphotransférase (un complexe protéique de 540 kDa composé de sous-unités \(\alpha\) et \(\beta\) et de deux sous-unités \(\gamma\)). Cette enzyme ajoute un N–acétylglucosamine–phosphate (à partir d'un UDP–GlcNac) sur le carbone–6 d'un ou plusieurs mannoses de la cupule (voir figure 26). Les mannoses concernés ne sont pas bien définis en raison de la grande mobilité des chaînes glucidiques. Pour finir, dans le compartiment golgien médian, les groupements N–acétylglucosamine sont éliminés par une phosphodiestérase laissant le seul groupement phosphate sur le(s) mannose(s). Toutes les enzymes lysosomales sont traitées de la sorte, si bien que le mannose–6–phosphate sert comme « glucide de destination » lysosomal.