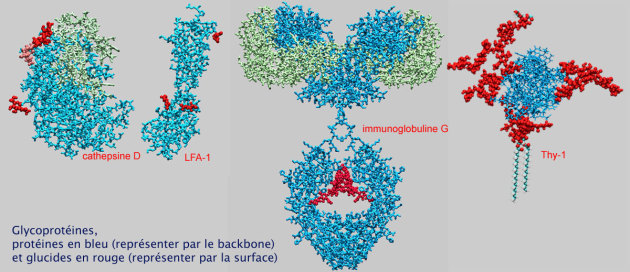
Elaboration de glycoprotéines et de protéoglycanes
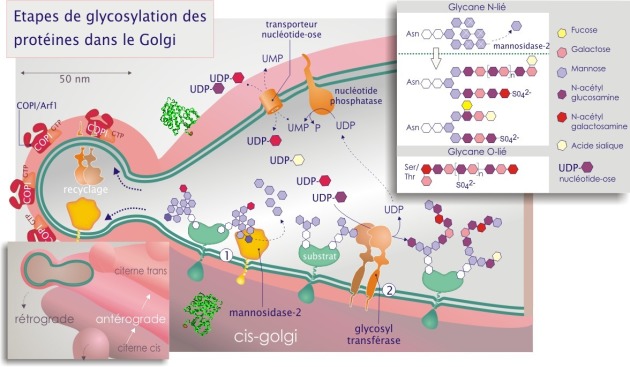
Après la N–glycosylation, la majorité des protéines entrant dans le Golgi possèdent une cupule glucidique (GlcNac2Man9) qui va être élaguée par la mannosidase–2, ne laissant que 3 à 5 résidus mannose (en plus des deux GlcNac) (voir la figure 24). La N–acétylglucosaminetransférase qui agit ensuite, dicte le type de branchement des nouveaux oses greffés. Après le rajout des acétylglucosamines, les branches sont allongées par des di–saccharides composés de galactose–N–acétylglucosamine (en formant des chaînes polylactosamine). Après une ou plusieurs additions de ces di–saccharides, les chaînes sont terminées par l'ajout de galactose, de N–acétylgalactosamine, de L–fucose, d'acide sialique ou d'un groupement sulfate.
Un autre processus consiste en la formation de très longues chaînes par répétition d'un motif disaccharidique du type galactose et N–acétylglucosaminesulfate (kératane) ou du type acide–D–glucuronique et N–acétylglucosaminesulfate (chondroïtine sulfate). On parle alors de protéoglycanes au lieu de glycoprotéines. Dans la ressource sur les « molécules d'adhérence », nous avons déjà évoqué l'exemple de l'aggrécane, protéoglycane majeur du cartilage hyalin [pdf]).
La glycosylation se fait sans matrice préexistante. Cependant, le nombre limité de séquences oligosaccharidiques présentes sur les protéines et les lipides, suggère qu'un ordre existe. Cet ordre est probablement dû à deux mécanismes au moins :
séquestration de glycosyltransférases, glycosidases et de transporteurs de nucléotide–sucres dans certaines citernes golgiennes (compartimentation des activités enzymatiques résultant en une véritable chaîne de montage), et
amas d'enzymes et transporteurs de nature spécifique, assurant simultanément une séquence précise (et probablement définitive) de modifications d'une seule chaîne glucidique.
La réalité de ses deux mécanismes est bien démontrée. Certaines glycosyltransférases sont restreintes à une ou deux citernes golgiennes précises ; par exemple, N–acétylglucosaminyl transférase ne se trouve que dans les citernes médianes. A l'inverse, les trois types de N–acétylgalactosyl transférases sont présents dans toutes les citernes golgiennes. On trouve aussi des associations d'enzymes, par exemple mannosidase–2 avec N–acétylglucosyl transférase ou encore sialyl–transférase–1 avec galactosyl–transférase–1 et sialyl–transférase–2. Le signal de rétention spécifique réside probablement dans la portion N–terminale cytoplasmique de ces enzymes et les mécanismes précis restent encore à élucider.
NB : La grande chaîne de glycosaminoglycanes qui constitue l'acide hyaluronique est assemblée dans le cytoplasme et non dans le Golgi. Rappelons que ce glycosaminoglycane est un composant très courant de la matrice extracellulaire mais jamais lié aux protéines par covalence.
Remarque : Glycosylation et viabilité cellulaire
Dans des cultures cellulaires, la N–glycosylation dans le REr, c'est-à-dire l'ajout de la cupule glucidique, est indispensable à la viabilité de la cellule. En revanche, l'absence des modifications ultérieures qui amènent à l'élaboration de chaînes oligosaccharidiques complexes, n'a pas de conséquences néfastes pour la cellule. Cependant, chez des embryons de souris, le manque de N–acétylglucosamine transférase–1, enzyme clé dans la formation de branches glucidiques, se traduit par la mort fœtale vers la mi-gestation (2 semaines).
On connaît peu de choses à propos de l'importance de l'O–glycosylation. La présence de longues chaînes glucidiques doit avoir un effet sur : 1/ la conformation des protéines et 2/ l'accès de certaines protéases (et donc réduction des risques de protéolyse). De plus, ces chaînes de glucides sont impliquées dans les interactions cellule–cellule dues aux molécules d'adhérence. Par exemple GlyCAM, CD34, MadCAM–1 et PSGL sont fortement glycosylées et .
Complément : Excursion : Localisation de l'activité de transport des nucléotides-oses et les glycosyltransférases
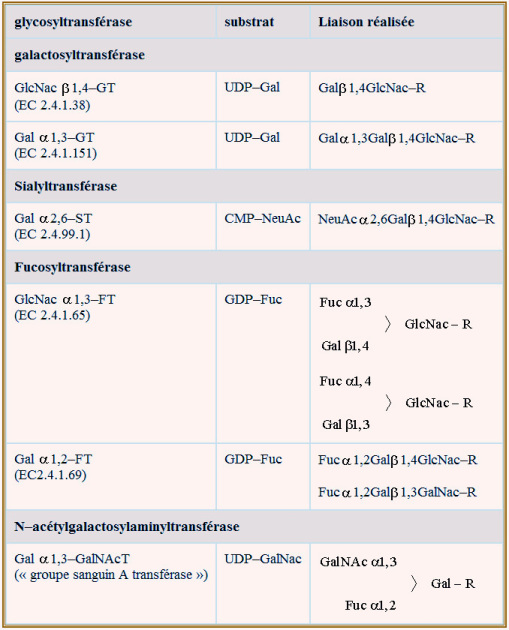
Ces enzymes sont nommées d'après l'ose qu'elles transfèrent sur la branche de l'oligosaccharide et d'après le type de liaison qu'elles élaborent.
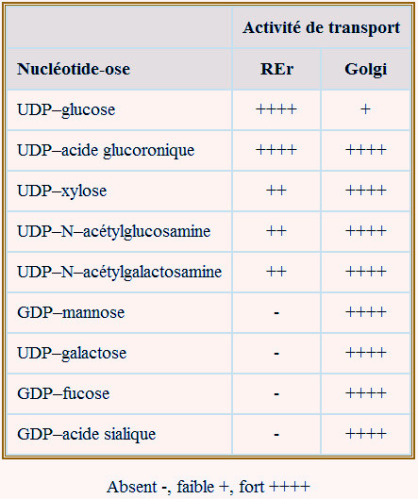
Exemples : \(\beta\)1–4 galactosyltransférase; \(\alpha\)2–6 sialyltransférase; \(\alpha\)1–3 N–acétylgalactosaminyltransférase. On pense que, environ 100 glycosyltranférases (elles-mêmes glycoprotéines) participent à la production et à la « maturation » des glycoprotéines. Les substrats greffés sont des nucléotide-oses (exemples UDP–glucose, CMP–acide sialique ou GDP–mannose, ce dernier exclusivement présent dans le REr) et sont apportés par des protéines porteuses spécifiques (transporteur d'UDP–N–acétylglucosamine par exemple). Le passage de membrane se fait par antiport ; échange de nucléotide-ose contre un nucléotide monophosphaté (UDP–glucose contre UMP par exemple). Ceci implique la participation de nucléotide diphosphatases (UDPase ou GDPase) (voir figure 24).
![]() Pour en savoir plus, consultez les documents suivants : « glycosylation review Kornfeld » [pdf] (2109 Ko), et « sugar glycosyltransferases Paulson » [pdf] (573 Ko).
Pour en savoir plus, consultez les documents suivants : « glycosylation review Kornfeld » [pdf] (2109 Ko), et « sugar glycosyltransferases Paulson » [pdf] (573 Ko).