Troisième GTPase : Arf1 et son rôle dans la transformation du compartiment ERGIC en citerne cis-golgienne
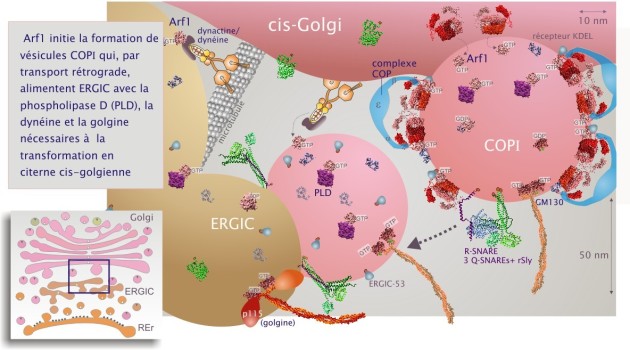
Le compartiment ERGIC est aussi alimenté par des vésicules de fusion qui proviennent de la face cis-golgienne (transport rétrograde) lors d'un processus qui implique les SNAREs et les golgines (GM130, giantine et p115). Ces vésicules cis-golgiennes, appelées apportent une troisième GTPase, Arf1 (ADP ribosylation factor). Arf1 a une forte parenté de séquence avec Sar1. Après son chargement en GTP par le facteur d'échange GBF1, Arf1 est indispensable à la transformation du compartiment ERGIC en citerne cis-golgienne. Arf1–GTP recrute de nombreuses protéines cytosoliques dont la phospholipase–D (PLD) et les phosphatidylinositol kinases (PI kinases) pour modifier les lipides membranaires et leur conférer leur caractère golgien très différent de celui du REr (voir figure 21).
pour plus de détail sur la phospholipase D.
pour plus de détail sur la liaison du réseau cis-golgien aux microtubules.
Arf1 lie aussi le compartiment ERGIC aux microtubules (cytosquelette) en recrutant la protéine dynéine–1 (protéine motrice qui migre vers l'extrémité moins du microtubule), l'adaptateur dynactine et la protéine non-motrice GMAP–210 () (voir figure 21 et cliquez sur les deux loupes sous la figure pour plus de détails). Ces protéines sont nécessaires à la fois au déplacement du compartiment ERGIC et à la stabilisation des citernes cis-golgiennes. Les évènements qui conduisent à la transition entre ERGIC et Golgi demeurent encore mal connus.
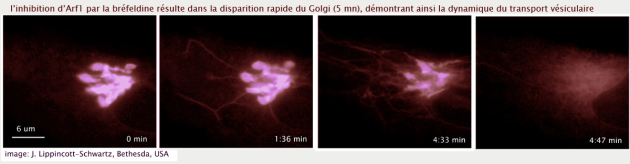
Le verrouillage de l'Arf dans son état GDP, par remplacement du résidu thréonine 31 en asparagine (T31N) ou par traitement de la cellule par la bréfeldine (métabolite fungique qui inhibe le facteur d'échange GBF1) ne gène pas le bourgeonnement de vésicules à partir du REr mais bloque la biogénèse du Golgi (en bloquant la maturation de l'ERGIC en cis Golgi) (voir figure 22)
![]() Pour visualiser de façon plus précise la complexité du Golgi, nous suggérons de consulter les documents suivants : « Les principes de la tomographie McIntosh » [pdf] (487 Ko), et « Le Golgi en tomographie McIntosh » [pdf] (1367 Ko).
Pour visualiser de façon plus précise la complexité du Golgi, nous suggérons de consulter les documents suivants : « Les principes de la tomographie McIntosh » [pdf] (487 Ko), et « Le Golgi en tomographie McIntosh » [pdf] (1367 Ko).
Complément : Excursion : rôle des protéines liant le GTP dans la dynamique de transport vésiculaire
Dans la ressource « cytosquelette », nous avons vu comment l'hydrolyse de l'ATP, dans le cas de l'actine, et celle de GTP, dans celui de la tubuline, confère une nature dynamique au processus de polymérisation. Lorsqu'elles sont chargées en ATP ou GTP, ces protéines ont une tendance à se polymériser [pdf] et après un certain temps, quand les nucléotides triphosphatés sont hydrolysés en nucléotide diphosphatés, à se dépolymériser. Nous avons aussi montré que l'association transitoire de facteurs d'initiation (eIF) et élongation (eEF) [pdf] au ribosome a lieu sous la dépendance de GTP et de son hydrolyse en GDP et Pi.
Les petites protéines liant le GTP et orchestrant le trafic vésiculaire (Arf, Rab et Sar) existent aussi sous deux états : un état actif, dans lequel elles sont chargées en GTP et liées à la membrane, capables de recruter d'autres protéines, et un état inactif, dans lequel elles sont chargées en GDP et pas nécessairement liées à la membrane. C'est l'hydrolyse de GTP qui détermine le passage de l'état actif à l'état inactif et c'est le remplacement de GDP par GTP qui effectue le passage inverse. En tube à essai, le remplacement de GDP par GTP est lent, de l'ordre d'une minute à une heure alors que l'hydrolyse de GTP se réalise en une minute environ (processus aléatoire non-déterministe qualifié de « stochastique »). Cependant, dans la cellule vivante, le turnover est, semble-t-il, beaucoup plus rapide, de l'ordre de quelques dizaines de secondes. En effet, dans une cellule mammalienne, l'assemblage et la dislocation des structures COPII se fait en moins de 60 secondes. Ceci est dû à l'intervention facilitatrice des GEFs (Guanine nucleotide Exchange Factors), qui stimulent l'échange GDP contre GTP, et des GAPs (GTPase Activating Proteins) qui stimulent l'hydrolyse de GTP en GDP et Pi. Dans le cas Sar1p, sur lequel nous reviendrons plus loin, le GEF est la protéine Sec12p et le GAP est la protéine Sec23, elle-même composante du manteau.
Plus loin, nous montrons que les différentes protéines liant le GTP peuvent jouer divers rôles dans le trafic vésiculaire. Dans un souci didactique, nous en donnerons une vision « simplifiée », mais on doit garder à l'esprit le fait que chaque famille de protéines liant le GTP (Arf, Rab et Sar) est composée de plusieurs membres, chacun ayant un rôle spécifique dans la formation du manteau, la sélection de la charge, le recrutement des enzymes de modification de la membrane, le recrutement des protéines motrices et d'arrimage ou la sélection du compartiment accepteur. A ce jour, chez les mammifères, on compte 6 membres pour la famille Arf, 60 pour la famille Rab et seulement 2 pour la famille Sar. Si, à cela, on ajoute l'existence de différents variants de GEF et de GAP et la présence d'inhibiteurs de GTPases, tels que RabGDI, on conçoit que la compréhension globale du processus de transport vésiculaire ne soit pas encore une réalité. D'un point de vue très généraliste, on peut également rappeler que les protéines liant le GTP exercent, à différents moments, différents rôles dans différents compartiments cellulaires, illustrant ainsi de façon spectaculaire la dimension spatio-temporelle de la fonction protéique.
En ce qui concerne sa localisation subcellulaire, Sar1p est toujours lié à la membrane non par l'intermédiaire d'un lipide associé mais grâce à une séquence N–terminale hydrophobe MSFIFEWIYNGF. En revanche, Arf, qui possède un , et Rab, qui possède deux groupements géranylgéranyl, peuvent effectuer un mouvement de va et vient entre la membrane et le cytoplasme. En position cytosolique, Arf cache son myristyl à l'intérieur d'une poche hydrophobe, et Rab cache ses groupements géranylgéranyl à l'intérieur d'une protéine associée, RabGDI (Guanine nucléotide Dissociation Inhibitor).
![]() Pour en savoir plus, consultez les documents suivants : « COPII Antonny-Schekman » [pdf] (77 Ko), « Turning on Arf, Jackson-Casanova » [pdf] (1306 Ko), et « PLD Golgi Freyberg » [pdf] (363 Ko).
Pour en savoir plus, consultez les documents suivants : « COPII Antonny-Schekman » [pdf] (77 Ko), « Turning on Arf, Jackson-Casanova » [pdf] (1306 Ko), et « PLD Golgi Freyberg » [pdf] (363 Ko).