Trafic moléculaire au travers du pore
A/ Import
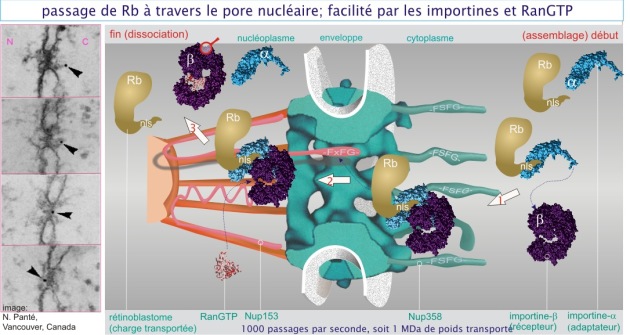
Les protéines entrantes, portent la séquence de destination NLS (Nuclear Localisation Signal), constituée d'acides aminés basiques (lysine et arginine) qui s'arrangent en une séquence continue –phe–lys–lys–lys–arg–lys–val– ou en une séquence interrompue –lys–arg–phe–ala–ala–thr–lys–lys–ala–gly–gln–ala–lys–lys–lys–lys–. Ces séquences sont reconnues par une protéine adaptatrice, l'importine–\(\alpha\) (protéine de 60 kDa), qui ensuite reconnaîtra son récepteur, l'importine–\(\beta\) (protéine de 97 kDa). Le complexe ainsi formé se fixera aux filaments cytoplasmiques qui bordent le pore, sur une séquence riche en phénylalanine et glycine (séquence –phe–ser–phe–gly–) de la protéine Nup358 (voir figure 9). C'est l'amorce d'un processus de navette qui se déroule comme suit : le complexe formé de la protéine entrante, de la protéine adaptatrice et de son récepteur, franchira en bloc le pore, probablement attiré par une autre séquence riche en phénylalanine et glycine (FxFG dans figure 9) située sur la protéine Nup153. Cette protéine est une protéine « élastique » et peut adopter des formes « rétractées » ou « étirées ». Après avoir été apporté dans le nucléoplasme par Nup153, le complexe récepteur-adaptateur est libéré de sa charge par une protéine liant le GTP, RanGTP (protéine de 24 kDa) (événements illustrés en figure 9). Il existe des protéines (non évoquées ici) qui renvoient les importines–\(\alpha\) et –\(\beta\) vers le cytoplasme pour y être « rechargées ».
pour plus de détail sur les protéines de transport à travers le pore nucléaire.
Il faut noter que certaines protéines se fixent directement au récepteur, importine–\(\beta\), sans intervention de l'adaptateur et aussi que certaines protéines semblent passer le pore sans aucune intervention de RanGTP, donc sans besoin apparent du récepteur.
Remarque : La protéine rétinoblastome
Dans la figure 9, nous donnons un exemple précis de la protéine rétinoblastome qui a une séquence de destination interrompue (« bipartite ») dans son extrémité C–terminale (–lys–arg–ser–ala–gly–ser–asn–pro–pro–lys–pro–leu–lys–lys–lys–leu–arg–, pour plus de détails sur la protéine rétinoblastome). Cette protéine entre dans le noyau à l'aide de l'importine–\(\alpha\) et de l'importine–\(\beta\). La protéine rétinoblastome est importante dans la régulation de la prolifération cellulaire. Sa présence dans le noyau rend certaines portions de l'ADN (où elle se fixe avec d'autres protéines) moins accessibles aux ARN polymérases et par cela, elle empêche la transcription des gènes qui normalement préparent la cellule pour un cycle de division (elle se présente donc comme un « suppresseur de tumeur »).
B/ Export
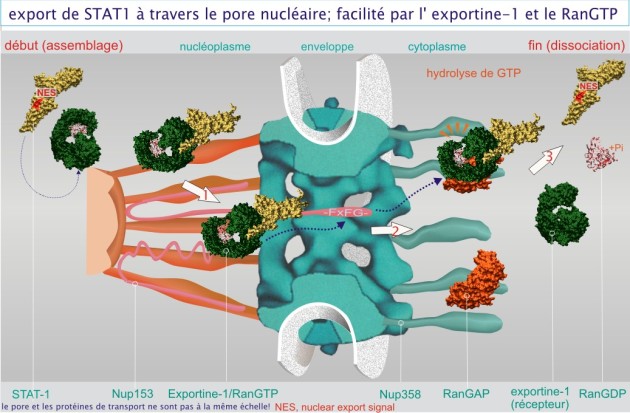
Les protéines destinées à sortir du noyau portent aussi une séquence de destination, appelée « nuclear export signal » (NES). Elle est riche en résidus leucine (non polaires) distribués le long de la chaîne (-leu-x1 -3-leu-x2-3-leu-x-leu/ile). Le processus d'exportation s'effectue selon des principes qui sont très proches de ceux des processus d'importation, utilisant des récepteurs spécifiques tels que exportine–1 (aussi appelé CRM1 (chromosome region maintenance protein–1, protéine de 123 kDa). L'exportine–1 reconnaît sa charge en fixant le RanGTP (au contraire de l'importine–\(\beta\)). Le complexe se déplace dans le pore grâce à l'interaction avec des protéines contenant une séquence riche en phe–x–phe–gly (par exemple Nup153 et Nup214). Dans le cytoplasme le complexe se fixe à un filament cytoplasmique (Nup358) et à RanGAP (GTPase activating protein). Celle-ci est une protéine qui provoque l'hydrolyse de GTP (en GDP et Pi). Le complexe se dissocie en libérant sa charge dans le cytoplasme (événements illustrés en figure 10).
pour plus de détail sur la GTPase Ran, son activation et sa dé-activation.
Pour ce qui concerne la sortie des très nombreux ARN (ARNt, ARNm, ARNr), les choses ne sont pas encore très claires. Il existe une protéine, , qui se fixe aux ARNm et qui a aussi la capacité d'interagir avec les protéines du pore nucléaire qui portent la séquence phe–x–phe–gly. TAP peut donc fonctionner comme une « exportine ». Cependant il existe un récepteur spécifique des ARNt : l'exportine–t (protéine de 111 kDa). Lorsqu'elle est liée au RanGTP, elle se fixe à l'ARNt mature et comme l'exportine–1 (CRM1), elle interagit avec les protéines nucléoporiques et perd sa charge après hydrolyse de GTP coté cytoplasme.
Remarque : La protéine STAT-1
Dans la figure 10, nous donnons un exemple précis du signal d'exportation (NES) de la protéine STAT–1 (« signal transducer and activator of transcription–1 ») dont la séquence de destination est la suivante : leu–trp–asp–arg–thr–phe–ser–leu–phe–gln–gln–leu–ile–gln–ser–ser–phe–val–val–glu. STAT–1 est un facteur de transcription (poids moléculaire 87 kDa) localisé dans le cytoplasme et le noyau. STAT–1 entre rapidement dans le noyau (sous une forme dimère induite par une phosphorylation sur un résidu tyrosine), en réponse à des signaux de médiateurs de l'inflammation tels que TNF–\(\alpha\) ou INF–\(\alpha\). L'élimination de ces médiateurs entraîne la déphosphorylation de STAT–1 qui quitte le noyau. Ce processus est en partie régulé par l'exportine–1, fixée au signal nucléaire d'exportation de STAT représenté par la séquence amino acidique 302–320.
pour plus de détail sur la séquence de signal d'export.