9.1.2 Températures d'ébullition
Comme les alcools et les amines, les acides carboxyliques forment des liaisons hydrogènes. La conséquence directe de ces liaisons est une augmentation de la température d'ébullition par rapport à l'alcane correspondant.
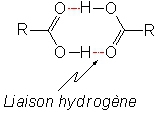
Fig. 5
ALCANES | ALCOOLS | AMINES | |||
|---|---|---|---|---|---|
Formule | T eb (°C) | Formule | T eb (°C) | Formule | T eb (°C) |
CH4 | -161.7 | CH3-OH | 65.0 | CH3-NH2 | -6.3 |
CH3-CH3 | -88.6 | CH3-CH2-OH | 78.5 | CH3-CH2-NH3 | 16.6 |
CH3-CH2-CH3 | -42.1 | CH3-CH2-CH2-OH | 97.4 | CH3-CH2-CH2-NH2 | 47.8 |
Les deux liaisons hydrogènes observées dans le cas des acides carboxyliques sont telles que la température d'ébullition est supérieure à celle des alcools.
Les effets de certains groupes sur l'acidité ne seront pas étudiés ici, pour cela se reporter au chapitre des effets électroniques dans la section généralités.





