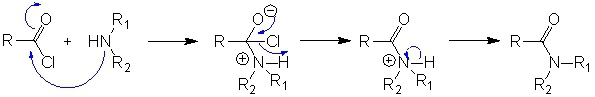
9.5 Préparation des amides
Les amides (secondaires ou tertiaires) sont obtenus à partir d'une amine (primaire ou secondaire) et d'un chlorure d'acide ou d'un anhydride d'acide, toujours selon le même mécanisme. C'est-à-dire que le doublet libre de l'azote (le nucléophile) vient taper sur le carbone du dérivé carbonylé (l'électrophile).
Les amides primaires sont quand à eux obtenus à partir d'ammoniac.
La réaction ne peut avoir lieu à partir d'acide carboxylique, car elle est réversible et redonne donc l'acide et l'amine.
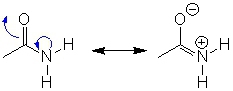
Les amides sont peu basiques (pKa = 17 pour le couple RCONH2/RCONH-) contrairement aux amines (pKa = 35 pour le couple RNH2/RNH-). Cette faible basicité est due à la délocalisation de la paire libre d'électrons sur l'atome d'azote par recouvrement avec l'orbitale π du carbonyle voisin.
La paire non liante du groupe NH2 est donc moins disponible pour former une liaison.
En terme de résonance, les amides sont plus stables et moins réactifs que les amines parce qu'ils donnent des formes de résonances.
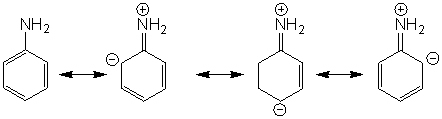
Toutes les amines n'ont pas un pKa aussi élevé il existe une exception, c'est le cas de l'aniline (pKa = 25). Car comme pour les amides, l'aniline présente des formes de résonances.
Il y a donc délocalisation dans tout le cycle aromatique. Le doublet libre de l'azote est donc moins disponible.