Mesure quantitative du dégagement d'oxygène
Comme vous l'avez appris au début de cet enseignement, la photosynthèse est un mécanisme biologique produisant de l'oxygène (section 1.2.2.2). L'activité de la photosynthèse peut donc être étudiée au travers de l'émission de ce gaz et l'expérience d'ENGELMANN vous en a convaincu. Un des biais de cette expérience est qu'elle ne permet pas de mesure quantitative de l'émission d'oxygène. Pour atteindre ce but et utiliser l'intensité de l'émission d'oxygène pour caractériser le processus photosynthétique, il est nécessaire de disposer d'appareillage particulier, adapté aux échantillons dont on dispose. Dans cette ressource, nous allons étudier le fonctionnement de deux méthodes utilisés pour la mesure du dégagement de l'oxygène.
Mesure du dégagement d'oxygène par des organismes photosynthétiques en solution : l'électrode CLARK - méthode polarographique
Cette électrode a été mise au point par le Professeur Leland CLARK (Figure 65) en 1953 (Clark et al. 1953) pour mesurer la quantité d'oxygène dans le sang. Elle a ensuite été adaptée à la mesure de l'oxygène émis par les organismes photosynthétiques en solution. Il s'agit d'un appareillage très sensible puisqu'il est capable de doser des quantités aussi faibles que 10-8 moles O2 cm-3.

Portrait of Dr. Leland C. Clark, Jr. on or about the date of being awarded the 2005 Fritz J. and Dolores H. Russ Prize, "for bioengineering membrane-based sensors in medical, food, and environmental applications." disponible sou slicence CC BY-SA 3.0. Disponible sur : https://en.wikipedia.org/wiki/Leland_Clark
L'électrode est composée d'une cathode de platine et d'une anode circulaire en argent (Figure 66A). Pour comprendre son fonctionnement, il est nécessaire de faire appel aux connaissances sur l'oxydo-réduction que vous avez acquises pendant vos études secondaires et à l'université à savoir que l'oxygène peut-être réduit en eau selon l'équation Eq1 suivante pourvu qu'un réducteur[1] soit présent dans le milieu pour fournir les électrons. Le potentiel d'oxydoréduction est de 0,81 V.
O2 + 4 H+ + 4e- → 2 H2O (Eq1)
Dans le cas de l'électrode, les électrons nécessaires à la réduction de l'oxygène sont fournis par la différence de potentiel (environ 800 mV) appliquées aux bornes de l'électrode. Donc au niveau de la cathode en platine, l'oxygène est réduit en eau par les électrons fournis par le système alors qu'au niveau de l'anode en argent, la réaction représentée par l'équation Eq2 se déroule.
4 Cl- + 4 Ag → 4 AgCl + 4 e- (Eq2)
Afin de permettre au courant de circuler entre les deux électrodes, elles sont reliées par un pont salin constitué par une solution concentrée de chlorure de potassium (Figure 66B). Comme vous l'avez noté, l'électrode de Clark a été créée pour l'étude d'échantillons placés en solution. Il est évident que si un tel dispositif est plongé dans une solution aqueuse, un court-circuit va se produire.
Il est donc indispensable de séparer le compartiment de l'échantillon du compartiment dans lequel le mesure sera effectuée. Pour que le dispositif fonctionne, il faut que la séparation soit imperméable à l'eau et perméable à l'oxygène. Pour atteindre cet objectif, une membrane semi-perméable en téflon fera l'affaire. Elle est maintenue en place par un anneau de caoutchouc (rubber O-ring dans la Figure 66B).
Pour les applications impliquant des échantillons photosynthétiques, il est impératif de disposer d'un système d'illumination. Comme ce dernier est souvent constitué d'une lampe à incandescence, apportant en plus des photons PAR de la chaleur, les parois de la cuve de l'échantillon doivent présenter deux particularités à savoir (1) être complètement transparente et (2) permettre la circulation d'un flux d'eau permettant l'évacuation des calories apportées par l'illumination. Pour ce faire l'échantillon est le plus souvent entouré d'une enveloppe creuse à double paroi et munie de deux orifices permettant la circulation du bain. Enfin, la cuve de l'échantillon doit pouvoir être fermée avec un bouchon afin de limiter les échanges de gaz entre l'échantillon et l'atmosphère. Un orifice étroit est souvent ménagé dans le bouchon afin de permettre l'injection de drogue(s) sans nécessiter l'ouverture de la cuve réactionnelle (Figure 66B).
Ce système d'électrode a été adapté aux mesures du dégagement d'oxygène dans l'air par les feuille.
La mise à disposition de système d'illumination moins riche en calories tel que les LED (Darko et al. 2014), révolutionnera sans doute la conception des cuves à échantillon des électrodes de CLARK.
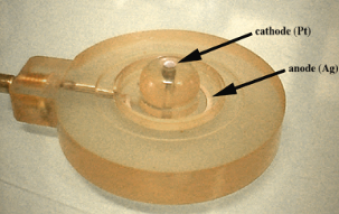
Le système électrochimique: L'électrode est composée d'une cathode et d'une anode circulaire en argent. Lorsqu'une différence de potentiel de 800 mV est appliquée aux bornes de l'électrode, l'oxygène est réduit en eau au niveau de la cathode alors que l'argent est oxydé en chlorure d'argent au niveau de l'anode. Afin de permettre au courant de circuler entre les deux électrodes, celles-ci sont reliées par un pont salin de chlorure de potassium concentré (voir le panneau A).
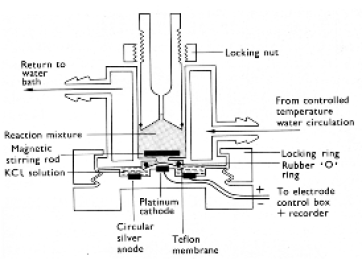
Schéma d'une coupe longitudinale: Si l'électrode est plongée dans une solution aqueuse, un court-circuit va se produire. Le compartiment de l'échantillon est donc séparé de l'électrode par une membrane semi-perméable en téflon (“Teflon membrane”). Elle est maintenue en place par un anneau de caoutchouc (“Rubber O ring”). La cuve de l'échantillon est complètement transparente et permet la circulation d'un flux d'eau permettant l'évacuation des calories apportées par l'illumination. Enfin, la cuve de l'échantillon est équipée d'un bouchon limitant les échanges de gaz avec l'atmosphère tout en autorisant l'injection de drogue(s).