L'expérience historique de Calvin-Benson-Bassham
Encadré : Principe expérimental
Afin d'identifier dans un premier temps, les produits biochimiques de la photosynthèse, attardons- nous sur l'expérience historique de Calvin-Benson-Bassham.
Comment suivre pas à pas les atomes de carbone fixés par la photosynthèse dans des cellules dans lesquelles les atomes de carbone sont légions ? Une tâche aussi difficile que de chercher une aiguille dans une botte de foin. La seule façon de le faire est de marquer les atomes de carbone entrant dans le chloroplaste. Dans les années 1950, la seule méthode disponible consistant à utiliser des molécules contenant un atome radioactif. Dans le cas du carbone, l'isotope utilisé est le 14C. Si l'on permet à une plante d'absorber du CO2 marqué au 14C (14CO2), le devenir de ces atomes pourra être suivi, car les molécules organiques dans lesquelles ces atomes ont été incorporés pourront être distinguées de leurs semblables fabriquées à partir du CO2 non marqué à condition d'utiliser la méthode dite du “pulse-chase”. Comme son nom l'indique, il s'agit d'incuber les cellules avec les molécules marquées pendant un court moment (“pulse”) et ensuite de suivre l'évolution des atomes marqués (“chase” ou chasse). Donc, les scientifiques de l'époque disposent d'une méthode permettant d'étudier le cheminement des atomes de carbone dans le métabolisme cellulaire. Encore fallait-iil être en mesure d'arrêter les réactions rapidement afin d'isoler les intermédiaires. Il était dès lors impensable d'utiliser une plante terrestre pour effectuer cette expérience car (1) il aurait fallu placer les plantes dans un milieu confiné dont l'atmosphère est enrichie en 14CO2 qu'il aurait fallu retirer ensuite après le “pulse” et (2) il faut trop de temps pour obtenir les tissus et en extraire les composés. CALVIN et ses collaborateurs, BASSHAM et BENSON (Figure 40), optèrent pour l'utilisation des organismes photosynthétiques aquatiques de petite taille, en l'occurrence des microalgues vertes (Chlorella sp. ou Scenedesmus sp.), que l'on peut facilement alimenter en 14CO2. Celui-ci peut être fourni sous forme d'hydrogénocarbonate (H14CO3-) en solution.

A. Melvin CALVIN
B. Andrew BENSON
C. James BASSHAM
Dispositif expérimental |
Le dispositif expérimental utilisé est présenté dans la figure 41. Les microalgues sont cultivées dans un bioréacteur transparent permettant l'illumination de la culture par de la lumière blanche. L'échauffement de la culture pendant l'expérience est évité à l'aide de filtres “anticaloriques” c'est-à-dire filtrant les rayonnements infra-rouges (Figure 41A). Le bioréacteur est équipé d'un entonnoir permettant le transfert de la culture de microalgues à utiliser, d'un tube permettant la circulation de l'air, et du CO2 et d'une sortie permettant la collecte des échantillons. La prise de l'échantillon est contrôlée par un électroaimant ouvrant et fermant rapidement l'orifice de sortie. Les échantillons sont tués instantanément en tombant dans un bain de méthanol chaud (“hot methanol”). La récolte des échantillons dans un espace de temps compatible avec la durée des réactions biochimiques et l'instantanéité de l'arrêt des réactions cellulaires constituent deux avantages essentiels de cet appareillage et ont assuré le succès des expériences. Une aiguille de seringue est ajoutée au dispositif. Elle permet l'injection de la solution d'hydrogénocarbonate marqué.
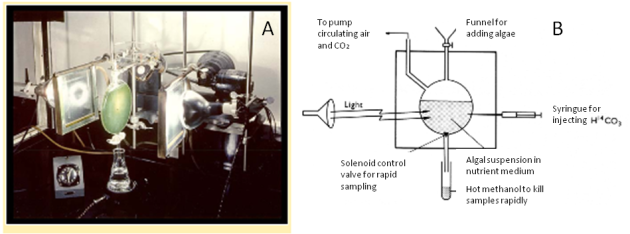
A. Photographie du dispositif expérimental.
B. Schéma explicatif du dispositif expérimental. Les microalgues (“algal suspension in nutrient suspension”) sont cultivées dans un bioréacteur transparent permettant l'illumination (“light”) de la culture. Le bioréacteur est équipé d'un entonnoir (“funnel”) permettant le transfert de la culture, d'un tube permettant la circulation de l'air et du CO2 (“to pump”) et d'une sortie permettant la collecte des échantillons. La prise de l'échantillon est contrôlée par un électroaimant ouvrant et fermant rapidement l'orifice de sortie (“solenoid control valve”). Les échantillons sont instantanément inactivés en tombant dans un bain de méthanol chaud (“hot methanol”). Une aiguille de seringue est ajoutée au dispositif. Elle permet l'injection de la solution d'hydrogénocarbonate marqué.
Protocole expérimental |
Une expérience typique se déroule de la manière suivante : une suspension de microalgues vertes est illuminée dans le bioréacteur. A un instant t, du 14CO2 radioactif sous la forme de H14CO3 est injecté. Après une durée précise et suffisante d'incubation (fraction de seconde jusqu'à quelques minutes selon les espèces de microalgues), une aliquote de la suspension est transférée dans 4 volumes d'alcool chaud (Calvin 1961). L'extrait alcoolique est traité de la manière suivante :
séparation des constituants par chromatographie bidimensionnelle : utilisation de deux mélanges (première direction : eau/phénol, seconde direction : butanol/acide propionique) (Figure 42A) ;
révélation du chromatogramme : utilisation de différents colorants spécifiques des molécules organiques d'intérêt (acides organiques : bleu de bromophénol, acides aminés : ninhydrine, sucres : naphtorésorcinol et composés phosphorylés : molybdate d'ammonium) ;
l'autoradiographie : la radioactivité étant invisible à l'oeil, il est nécessaire pour la localiser de recouvrir - à l'obscurité - des chromatogrammes non colorés à l'aide d'un film photographique contenant de l'halogénure d'argent. En effet, la lumière induit la précipitation de l'argent et la formation d'une image. Après un temps d'exposition, le film est révélé. Les taches sombres indiquent la présence des composés organiques contenant du carbone radioactif. La comparaison des chromatogrammes colorés et des chromatogrammes révélés par autoradiographie permet de déterminer la nature des produits synthétisés au cours de la photosynthèse en présence de 14CO2 (Figure 42B).

A. Schéma des manipulations permettant de séparer et de révéler les molécules organiques des microalgues par chromatographie bidimensionnelle.
B. Exemple de chromatogramme réalisé par TREMBLIN avec la macroalgue brune Fucus serratus.
Résultats expérimentaux
La figure 43 compare des chromatogrammes obtenus après 5 s et 15 s de chasse en présence d'hydrogénocarbonate marqué.
Questions :
Après observation des taches obtenues après 5 s de chasse, identifiez les produits biochimiques obtenus et interprétez les différences de taille de taches observées.
Comparez les taches obtenues après 15 s de chasse et celles obtenues à 5 s : quelles observations en faites-vous ? Comment interprétez-vous les différences observées ?
Pourquoi la tache PGA ne semble-t-elle pas modifiée ? Comment l'interprétez-vous ?
Quels sont finalement les composés biochimiques produits par la photosynthèse ?
Cadre de réponses 13 :
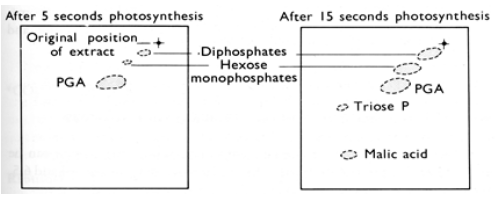
Après 5 s, 3 taches concentrent toute la radioactivité. Elles correspondent à des disphosphates, des monophosphates d'hexoses (“hexose monophosphates”) et de l'acide phosphoglycérique (PGA). La tache de PGA est la plus importante. Après 15 s d'incubation, deux nouvelles taches sont apparues, elles correspondent à des trioses phosphate (Triose P) et à l'acide malique.
Après 5 s de chasse, 3 taches concentrent toute la radioactivité. Elles correspondent à des disphosphates, des monophosphates d'hexoses (“hexose monophosphates”) et de l'acide phosphoglycérique (PGA). La tache de PGA est la plus importante. Après 15 s de chasse, deux nouvelles taches sont apparues, elles correspondent à des trioses phosphate (Triose P) et à l'acide malique.
Réponses :
- Après 5 s de chasse, 3 taches correspondant à des diphosphates, des monophosphates d'hexoses (“hexose monophosphate”) et de l'acide phosphoglycérique (PGA) qui concentrent toute la radioactivité. La tache de PGA est la plus étendue.
- 10 s plus tard, deux nouvelles taches sont apparues, elles correspondent aux trioses phosphates (“Triose P”) et à l'acide malique. Si la surface de la tache de PGA n'a pas changé, les taches correspondant aux diphosphates et monophosphates d'hexoses se sont agrandies. Ceci suggère qu'au cours des 10 s de chasse qui séparent les prises d'échantillons, les microalgues ont accumulé des diphosphates et monophosphates d'hexoses.
- Comme de nouveaux produits sont apparus et que la surface de la tache de PGA n'a pas changé, il s'agit sans doute d'un intermédiaire central du métabolisme du carbone.
- La comparaison des chromatogrammes d'échantillons récoltés régulièrement pendant quelques minutes a permis à CALVIN et ses collaborateurs (Calvin 1952, Bassham et Calvin 1959) d'identifierla nature et de déterminer la quantité de composés carbonés formés par la photosynthèse. Ces résultats sont aujourd'hui connus sous le nom de cycle de Calvin-Benson-Bassham. Calvin a obtenu le prix Nobel en 1961 pour ces travaux. Découvrons maintenant ce cycle (Fig. 44).
Le cycle de Calvin-Benson-Bassham |
Le cycle de Calvin-Benson-Bassham est commun à tous les organismes photosynthétiques. Il se déroule dans le stroma des chloroplastes. Sa particularité est d'intégrer le CO2 atmosphérique gazeux en le fixant sur des oses phosphorylés présents continuellement dans les chloroplastes. C'est ainsi que la matière organique est produite par autotrophie dans le monde du vivant
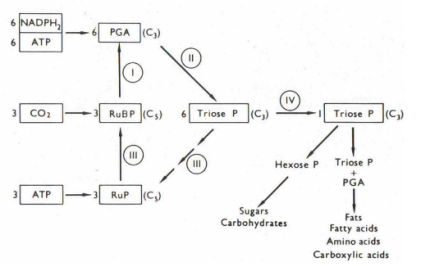
Le cycle de Calvin-Benson-Bassham peut être décomposé en plusieurs étapes.
Etape I : Trois molécules de CO2 sont fixées sur trois molécules de ribulose bis-phosphate (RuBP) pour donner 6 molécules de PGA. La réaction est catalysée par la RibUlose BISphosphate Carboxylase Oxygénase (RuBisCO),
Etape II : Chaque molécule de PGA est convertie en une molécule de triose phosphate. La réaction consomme pour chaque molécule de PGA une molécule de NADPH + H+ et une molécule d'ATP, produits au cours de la phase claire. Lorsque toutes les molécules de PGA issues de l'étape II sont consommées, 6 molécules de triose phosphate sont formées,
Etape III : 5 molécules de triose phosphate continuent dans le cycle et sont modifiées pour former trois molécules de ribulose-phosphate (RuP), qui une fois phosphorylées régénéreront le groupe de RuBP. Chacune de ces trois molécules de RuBP peut accepter une nouvelle molécule de CO2 et entrer à nouveau dans le cycle de Calvin-Benson-Bassham.
Etape IV : cette étape marque l'exportation du 6 ème triose phosphate du chloroplaste dans le cytoplasme où, moyennant différentes réactions, il entre dans le métabolisme des acides gras, des acides aminés, des acides carboxyliques et des autres molécules organiques. Notons que la molécule de triose phosphate peut ne pas être exportée dans le cytosol. Dans ce cas, elle est transformée en glucose, qui à son tour est incorporé dans le sucre de réserve, l'amidon. Nous découvrirons un peu plus tard comment l'exportation est régulée.
Approfondissement et réinvestissement |
Pour faire le point sur les connaissances que vous avez acquises et la compréhension du cycle de Calvin-Benson-Bassham que vous avez, amusez-vous à expliquer le fonctionnement du cycle à l'aide de cette vidéo (https://www.youtube.com/watch?v=E_XQR800AgM) et à résoudre les deux exercices présentés ci-dessous.
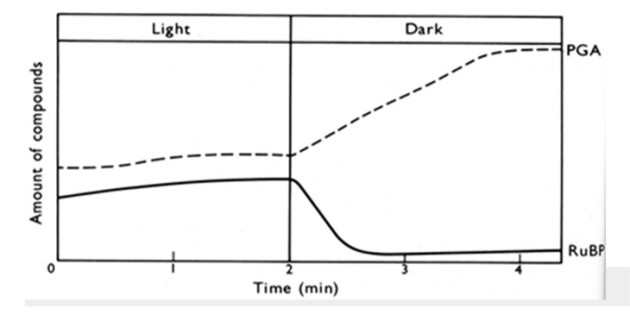
Dans le premier exercice, des microalgues sont cultivées en condition jour/nuit. A la lumière des conditions de cultures fournies, les quantités de PGA et de RuBP sont plus ou moins constantes. Lorsque l'éclairage s'éteint, la concentration en chacune de ces deux molécules change de manière importante. Expliquer ce résultat à l'aide d'un schéma.
Hall and Rao (1994) Photosynthesis. 5th edition, Cambridge Univ Press, Fig 6.6
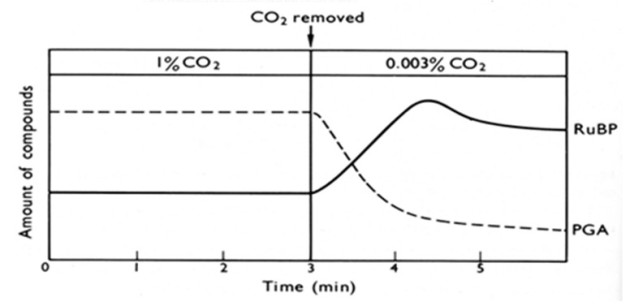
Dans le second exercice, les microalgues sont cultivées en lumière continue en présence d'une concentration en CO2 de 1%. Dans ces conditions, les quantités de PGA et de RuBP sont constantes. Lorsque l'approvisionnement en CO2 est réduit à 0,003%, les quantités de PGA et de RuBP changent à nouveau de manière importante. Expliquer ce résultat.
Hall and Rao (1994) Photosynthesis. 5th edition, Cambridge Univ Press, Fig 6.6