Phase 2. Fission et fusion des vésicules de transport
A) Fission
Les vésicules se détachent du compartiment donneur sous l'action d'une protéine capable de former un anneau qui étrangle progressivement le pédoncule de la vésicule jusqu'à ce que celle-ci se détache : ce processus est appelé « fission ». Dans le cas de fission de vésicules tapissées de clathrine (endocytose), ce rôle est pris par la dynamine, protéine liant le GTP. Cette action qui requiert un fort rayon de courbure de la bicouche lipidique est facilitée par l'action de l'endophiline, enzyme qui convertit l'acide lysophosphatidique (LPA) en acide phosphatidique (PA), deux lipides de conformation conique opposée. Ce mécanisme est bien connu pour ce qui concerne la fission des vésicules issues de la membrane plasmique mais beaucoup moins pour ce qui concerne celles qui proviennent du REr et du Golgi.
Une fois formée, la vésicule perd son manteau sous l'effet de l'hydrolyse du GTP porté par les protéines liant le GTP mais elle conserve la « machinerie protéique de fusion ». L'ensemble est maintenant prêt pour la fusion avec d'autres compartiments cellulaires.
![]() Pour en savoir plus, consultez le document suivant : « endophiline Anne Schmidt » [pdf] (122 Ko).
Pour en savoir plus, consultez le document suivant : « endophiline Anne Schmidt » [pdf] (122 Ko).
B) Fusion
La vision actuelle du processus est que les protéines SNARE sont à la base de la fusion des membranes mais que d'autres protéines, qualifiées d'accessoires de fusion, telles que les golgines (les protéines d'arrimage p115, giantine, GM130 etc.), l'ATPase NSF, les SM proteins, rSly et Munc18, ou encore –SNAP, doivent les assister dans leur fonction. Les protéines accessoires doivent leur qualificatif au fait que leur intervention dans la fusion n'est pas encore comprise. Elles sont cependant essentielles car, sans elles, la fusion membranaire testée par expérimentation in vitro, avec les seules SNAREs, met plusieurs heures à se réaliser. L'acronyme SNARE est expliqué dans la boîte ci-dessous.
C'est à propos de l'étude de la synapse et de ses vésicules de neurotransmetteurs que deux familles de SNAREs ont été identifiées. 1/ R–SNAREs, trouvées à l'origine sur les vésicules de neurotransmetteurs et donc initialement appelé v–SNAREs, et 2/ Q–SNAREs, trouvées à l'origine dans la zone présynaptique dense de la membrane plasmique cible (« target ») et donc initialement appelé t–SNAREs. La nomenclature initiale v– et t–SNARE est devenue caduque lorsqu'on a montré qu'une même vésicule du REr ou du Golgi porte les deux types de SNAREs. De plus, au cours du transport vésiculaire entre REr et Golgi, il n'est pas toujours possible de distinguer entre vésicule et cible (donneur et receveur). Les R–SNAREs sont toujours des protéines transmembranaires, alors que les Q–SNAREs sont soit transmembranaires (type II, protéine à N–terminal cytoplasmique et un seul segment transmembranaire) soit membranaires intrinsèques (ancrées par un myristate, SNAP–25). A ce jour, 35 protéines type SNARE ont été identifiées chez les mammifères (et 21 chez la levure).
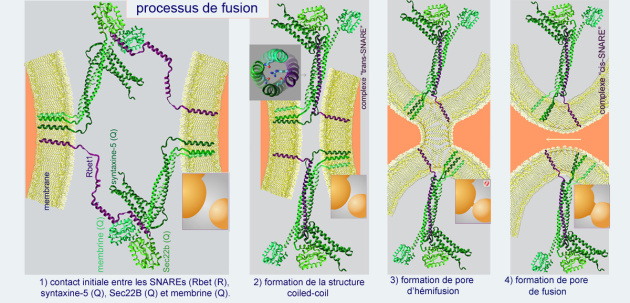
Les R– et Q–SNAREs ont une forte tendance à former des complexes protéiques très stables en s'associant en une structure en câble à quatre brins appelée « bundled coiled-coil ». Cette structure résulte de l'interaction de quatre « motifs SNARE » portés par des hélices amphiphatiques, dont trois proviennent de Q–SNAREs et une de R–SNARE (voir figure 15) Les préfixes R et Q réprésentent respectivement les acides aminés arginine (R) et glutamine (Q). Les R–SNAREs ont une arginine essentielle dans leur motif SNARE, alors que pour les Q–SNARE il s'agira d'une glutamine.
Pour être prêtes à la fusion, les Q–SNAREs doivent être d'abord « activées » pour former un complexe trimérique. Ceci fait, le complexe pourra réagir avec une seule R–SNARE de la membrane opposée (interaction « trans »), l'ensemble formant un bundled coiled-coil appelé SNAREpin, centré par les trois glutamines et l'arginine (voir figure 15, fusion–2). Ces changements de conformation rapprochent les deux membranes et permettent la fusion des bicouches lipidiques. L'établissement d'un complexe stable entre R– et Q–SNAREs constitue la force motrice de la fusion membranaire. Il s'agit d'une force considérable qui doit 1/ chasser l'eau présente entre les deux membranes lipidiques et 2/ déstructurer la bicouche pour former les assemblages lipidiques intermédiaires pendant la fusion (voir figure 15, fusion–3).
Souvent la fusion membranaire de vésicules de sécrétion requiert transitoirement une concentration intracellulaire élevée de Ca2+ (\( \sim\)200 nM) dans le but de compléter le cycle des évènements de fusion membranaire. Dans ce cas, on parle d'exocytose « régulée ».
Définition : Les acronymes SNARE, SNAP, NSF et sec
Ci-dessous nous précisons la signification des acronymes utilisés dans la dénomination des protéines impliquées dans la fusion : SNARE pour « SNAP receptor » ; SNAP (Sec17) pour « soluble NSF attachment protein » ; NSF (Sec18) pour « n–ethylmaleimide–sensitive factor » ; « sec », dénomination de plusieurs gènes mutés impliqués dans la « sécrétion » chez la levure.
Remarque : Neurotoxines et SNAREs
Les neurotoxines clostridiales produites par Clostridium botulinii, agent responsable du botulisme, et par Clostridium tetanii, qui provoque le tétanos, sont de très puissants inhibiteurs de la libération de neurotransmetteurs. L'intoxication des neurones par ces toxines entraîne l'hydrolyse des protéines SNARE, synaptobrévine, syntaxine ou SNAP–25 (selon la toxine). Ces résultats ont été étendus à d'autres types de cellules en introduisant expérimentalement les chaînes légères de ces toxines dans des fibroblastes et cellules épithéliales. L'ensemble de ces résultats a permis de montrer que les protéines SNAREs ont une position clé dans la machinerie de fusion des membranes.
Complément : Excursion : la découverte de SNARE, SNAP et NSF
La fusion membranaire est sensible au n–éthylmaléimide, un réactif utilisé pour la détection des groupes sulfhydryl des protéines et dont, aux alentours de 1975, on a montré l'activité inhibitrice de la libération d'histamine par les mastocytes, processus impliquant de nombreuses fusions membranaires. Au moins un des récepteurs intracellulaires du n–éthylmaléimide impliqués dans la fusion membranaire s'est révélé être une ATPase hexamérique (type AAA, ATPase Associated with a variety of Activities), appelée NSF (N–ethylmaleimide Sensitive Factor). NSF se fixe aux protéines de fusion SNARE par l'intermédiaire d'une protéine adaptatrice SNAP (SNF-associated protein). L'ensemble NSF-SNAP, a un rôle important dans le processus de fusion : il facilite la dissociation de SNAREpin, complexe de trois Q–SNAREs et une R–SNARE résultant de la fusion de deux membranes (configuration trans) ou d'une association accidentelle des Q– et R–SNAREs sur une même membrane (configuration cis). C'est en inhibant l'activité ATPase de NSF que le n–éthylmaléimide bloque l'endo et l'exocytose.
Pour la protéine initialement nommée SNAP, on précise maintenant \(\alpha\)–SNAP pour la distinguer d'une famille de protéines isolées à partir de synapses et identifiées par le même acronyme SNAP (« synaptosomal associated protein », par exemple SNAP–25).
L'hypothèse SNARE était à l'origine basée sur la découverte dans une fraction 20S d'un homogénat de cerveau centrifugé en gradient sucrose, d'un complexe stœchiométrique composé de v– et t–SNARE associé à SNAP et NSF (). En présence d'ATP tous les composants du complexe 20S sont nécessaires et suffisants pour assurer la fusion des vésicules entre elles. On sait maintenant que ce sont les SNAREs qui sont responsables de la fusion et que SNAP et NSF servent à garder les Q– et R–SNAREs dans un état dissocié et donc potentiellement compétents pour la fusion.
![]() Pour en savoir plus, consultez le document suivant : « Sollner et al, Nature 362, 318-324, 1993 » [pdf] (1,04 Mo)
Pour en savoir plus, consultez le document suivant : « Sollner et al, Nature 362, 318-324, 1993 » [pdf] (1,04 Mo)
![]() Pour savoir plus sur la famille de Dynamines consult le document suivant : « Dynamin, fission, GTPase 2012-Ferguson [pdf] »
Pour savoir plus sur la famille de Dynamines consult le document suivant : « Dynamin, fission, GTPase 2012-Ferguson [pdf] »