Phase 1. Sélection de la charge, formation du manteau et bourgeonnement : un processus trois-en-un initié par des petites GTPases
Le tri de la protéine constituant « la charge » implique :
la liaison de son « peptide de destination » à un récepteur
et la concentration du complexe dans un domaine membranaire limité appelé « site de sortie » (« exit site »). Ce site est caractérisé par la formation d'un bourgeon, tapissé du coté cytosolique par une couche protéique complexe hétérogène, appelée manteau (structure bien identifiée en microscopie électronique et dont l'aboutissement est la « coated vesicle » ou « vésicule tapissée »). Les récepteurs de la charge font partie de ce manteau et, avec d'autres protéines, élaborent la charpente de la vésicule en formation. Suivant le site de formation de la vésicule, le manteau est constitué de complexes protéiques spécifiques COP–I (Golgi), COP–II (REr), AP/clathrine (Golgi, endosomes et membrane plasmique), GGA (Golgi) et cavéoline (Golgi/membrane plasmique).
Selon la nature de la charge, deux cas au moins se présentent :
la charge est constituée de protéines transmembranaires (canaux ioniques, récepteurs cellulaires, molécules d'adhérence etc.) dont le peptide de destination cytosolique interagit directement avec le manteau ;
la charge est sous forme de protéines solubles qui se lient d'abord à un récepteur transmembranaire (adaptateur), lui-même lié au manteau par son domaine cytoplasmique. Très peu de données concernent l'identité des déterminants moléculaires tels que les adaptateurs et les séquences amino acidiques des peptides de destination. Bien que la formation de la vésicule tapissée puisse être obtenue expérimentalement in vitro en absence de charge, il est généralement admis que l'interaction entre le manteau et la charge renforce considérablement le processus.
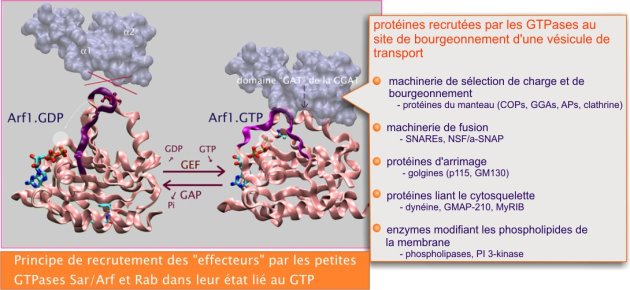
La formation du site de sortie est amorcée par de petites protéines liant le GTP, membres des familles Arf/Sar et Rab. Quand elles se trouvent en position membranaire (coté cytoplasmique) et liées au GTP, elle recrutent sélectivement des récepteurs (composant du manteau), des enzymes modifiant les lipides (phospholipases et PI kinases), des protéines motrices et des golgines (protéines d'arrimage). Ces protéines, à leur tour, recrutent d'autres protéines dont les importantes SNAREs, « protéines de fusion » (voir figure 14).
![]() Pour en savoir plus, consultez le document suivant : « COP, clathrin coated vesicle budding McMahon » [pdf] (418 Ko).
Pour en savoir plus, consultez le document suivant : « COP, clathrin coated vesicle budding McMahon » [pdf] (418 Ko).
Complément : Excursion : les APs et GGAs sont collectivement regroupées sous l'appellation « adaptines »
Les APs (adapter proteins) sont des complexes hétérotétramériques qui assurent l'incorporation de la charge dans des vésicules de transport grâce à leur interaction avec les peptides de destination présents dans le domaine cytoplasmique des protéines transmembranaires. Quatre complexes APs sont caractérisés: AP–1(\(\beta\)1,\(\gamma\),\(\mu\)1A ou \(\mu\)1B,\( \sigma\)1), AP–2 (\(\beta\)2,\(\alpha\),\(\mu\)2,\(\sigma\)2) AP–3\(\beta\)3,\(\delta\),\(\mu\)3,\(\sigma\)3) et AP–4 (\(\beta\)4,\(\varepsilon\),\(\mu\)4,\(\sigma\)4) (). AP–1 et AP–3 sont impliqués dans le tri au niveau du réseau trans-golgien et des endosomes, alors qu'AP–2 intervient dans la formation des vésicules tapissées de clathrine à partir de la membrane plasmique. Enfin AP–4 sélectionne les protéines destinées au transport basolatéral dans le Golgi des cellules épithéliales.
Les GGAs (Golgi-localized, gamma ear-containing, ARF-binding protein 1) sont des protéines monomériques recrutées à la membrane trans-golgienne par la GTPase Arf. Elles jouent un rôle dans la séquestration, par les récepteurs du mannose–6–phosphate, des hydrolases lysosomales au niveau des citernes trans-golgiennes (). Trois GGAs, nommées GGA1, 2 et 3, ont été identifiées chez l'Homme.