Régulation du taux d'expression des protéines
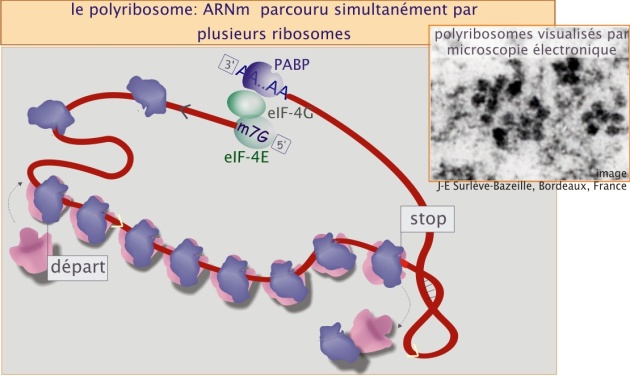
La synthèse complète d'une protéine de 50 kDa nécessite environ 64 secondes. Autrement dit, le ribosome parcourt l' ARNm en 64 secondes. Cependant il est possible que le même ARNm soit simultanément parcouru par plusieurs ribosomes, formant ainsi un polyribosome (voir figure 16), augmentant donc considérablement la capacité de la traduction et, en conséquence, la synthèse protéique. Cependant le nombre des ribosomes est limité. Par exemple, un ARNm codant 490 acides aminés mesure environ 245 nm. Etant donné qu'un ribosome occupe 30 nm, on peut estimer que cet ARNm ne peut héberger simultanément que 8 ribosomes.
La formation de polyribosomes est dépendante de la vitesse d'initiation de la traduction. Ce processus est régulé par les facteurs d'initiation qui pour leur part sont régulés par des signaux externes, provenant entre autres des facteurs de croissance. Pour donner une idée de l'échelle du phénomène, on peut dire qu'une cellule en division nécessite un taux de synthèse trois fois plus élevé qu'une cellule quiescente.
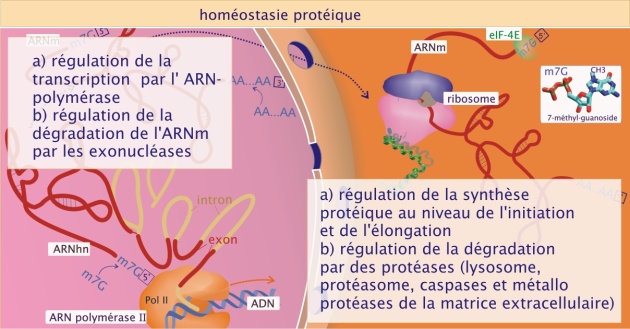
Il existe aussi d'autres niveaux de régulation de la production de protéines : l'un basé sur la sélection de l'ARNm à traduire (il existe des ARNm disponibles dans le cytoplasme qui sont très peu traduits) et l'autre basé sur la durée de vie, limitée à quelques heures, de l' ARNm. Une production intense de protéines nécessitera donc la synthèse permanente d'ARNm par persistance du processus de transcription. A l'inverse, une cellule limitera la production d'une protéine donnée en interrompant la transcription du gène concerné ou en dégradant rapidement son ARNm (voir figure 17).
Complément : Excursion : la stabilité de l'ARNm
La durée limitée de la vie de l'ARNm est un facteur important dans la régulation de l'expression des protéines. La demi-vie d'un ARNm peut varier de quelques minutes ( ARNm codant le facteur de transcription c-fos), à quelques heures (majorité des ARNm) et se prolonger à quelques jours (ARNm codant la globine et l'ovalbumine). Les ARNm à faible durée de vie ont souvent une séquence nucléotidique riche en AU dans leur région \(3'\)non traduite. Cette séquence cible l'ARNm vers une destruction par le complexe exosome (composé de nombreuses exonucléases, ).
Des signaux extracellulaires peuvent influencer la durée de vie de l'ARNm. Par exemple, dans des conditions inflammatoires, la cytokine IL–4 augmente celle de l'ARNm de VCAM–1 causant alors une augmentation de l'expression (en quantité et en temps) de cette molécule d'adhérence. De façon identique, la prolactine, hormone hypophysaire stimulant la lactation, stabilise l'ARNm codant la caséine, protéine majeure du lait, augmentant ainsi la production lactée (sans changement de l'expression du gène).
Enfin, l'infection par de courts fragments d'ARN viral double brin, contenant des séquences capables de s'hybrider avec certains ARNm de l'hôte (par appariement des bases), entraîne une destruction rapide de ces ARNm. Ce mécanisme, qui prive la cellule de certains de ses ARNm est connu sous le nom « d'ARN interférant » (ARNi ou RNAi en anglais). Il est maintenant instrumentalisé à grande échelle, par l'utilisation d'ARN double brin bien déterminés (sondes), pour étudier la fonction de milliers de protéines récemment découvertes lors du déchiffrage du génome complet de plusieurs eucaryotes (Drosophila melanogaster, Caenorhabditis elegans et Homo sapiens sapiens).