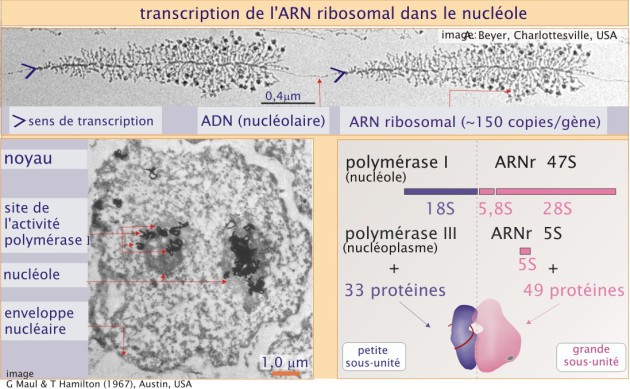
ARN ribosomal ; ribosome
Chez l'homme, le ribosome est une particule de 30 nm de diamètre, formée de deux sous-unités de taille inégale, la petite sous-unité (aussi appelée 40 S) et la grande sous-unité (aussi appelée 60 S). Elles sont composées de quatre chaînes d'ARN ribosomal et de nombreuses protéines. Le génome humain contient environ 200 gènes identiques codant l'ARN ribosomal (ARNr), répartis sur 5 chromosomes (13, 14, 15, 21 et 22). Chaque gène est transcrit dans le nucléole, plus précisément dans les zones fibrillaires, par une ARN polymérase I, en un précurseur de 47 S (14 000 bases d'une longueur de 0,4\( \mu m\)) (voir figure 11, panneau supérieur, représentant deux gènes codant le 47 S en cours de transcription par de nombreuses unités d'ARN polymérase type I). Certaines séquences de ce précurseur sont excisées, ce qui donne naissance aux séquences 5,8 S et 28 S (pour assemblage de la grande sous-unité) et 18 S (pour celui de la petite sous-unité). Ceci est une façon simple d'assurer une production équilibrée des différents composants du ribosome (dans une stœchiométrie 1:1). L'ARNr 5 S, qui participe aussi à la grande sous-unité du ribosome, est transcrit par l'ARN polymérase III dans le nucléoplasme, et est codé par un gène différent.
33 protéines et l'ARNr 18 S composent la petite sous-unité alors que la grande sous-unité est formée de 49 protéines et trois ARNr 5 S, 5, 8 S et 28 S. Toutes ces protéines sont importées dans le noyau où elles se combinent à l'ARNr pour former les ribosomes.
Malgré la présence des nombreuses protéines, l'ARNr demeure majoritaire en masse (un nucléotide est en moyenne quatre fois plus lourd qu'un acide aminé). De plus, par son arrangement spatial, imposé par sa séquence nucléotidique et l'appariement des bases complémentaires, c'est lui qui assure la structure du ribosome (voir figure 12). Cette structure établit des sites précis où se feront les interactions des sous-unités ribosomales avec l'ARNm et l'ARNt. Elle détermine aussi le site de l'activité peptidyl transférase (l'enzyme qui réalise la liaison peptidique entre les acides aminés). La particule complète (40 S + 60 S) n'est assemblée que dans le cytoplasme, en présence de lARNm, l' ARNMet initiateur et des facteurs d'initiation (eIF).
Les images qui illustrent le texte montrent des ribosomes de procaryotes car plus étudiés sur le plan structural que ceux des eucaryotes. Les ribosomes des eucaryotes semblent très similaires, mais non identiques. Par exemple, le ribosome bactérien est plus petit en taille, a moins de protéines et des ARNr plus courts, ce qui est bien reflété par les constantes de sédimentation (Svedberg) de ses sous-unités : 30 S et 50 S respectivement pour la petite et la grande, versus 40 S et 60 S chez les eucaryotes. Les particularités moléculaires qui sont à la base de ces différences rendent les ribosomes bactériens plus sensibles aux antibiotiques que les ribosomes d'eucaryotes (ce que l'on appelle, dans l'industrie pharmaceutique, les différences exploitables).
Complément : Excursion : ARN et protéines constituent le ribosome
Les composants de l'ARNr du ribosome et leur poids :
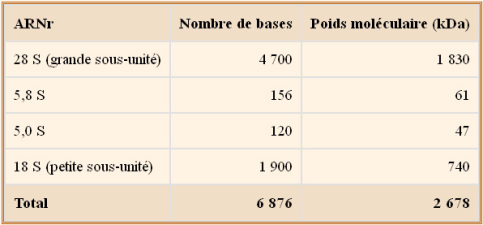
Le poids total d'un ribosome est estimé à 4 600 kDa, ce qui montre que l'ARNr est majoritaire par rapport à la masse protéique (d'environ 2 000 kDa).
Expérimentalement, chez les bactéries, il a été montré que des ribosomes constitués exclusivement d' ARNr sont capables de traduction, montrant ainsi que l'ARN assume à la fois un rôle structurel et enzymatique (on le qualifie de ribozyme). Les ARNr facilitent la translocation de l'ARNm, le passage de la chaîne protéique en élaboration et l'activité peptidyl transférase. Cependant, il est certain que la composante protéique du ribosome joue un rôle important chez les bactéries car elle augmente considérablement l'efficacité de traduction. Chez les eucaryotes elle est même strictement indispensable aux processus de traduction.
Certaines protéines ribosomales des eucaryotes ont « une double vie ». Un exemple démonstratif concerne le rôle de la protéine ribosomale L13A dans l'expression de la céruloplasmine dans les leucocytes. Lorsque ces cellules sont exposées à l'interféron\(–\gamma\), cytokine inflammatoire, L13A qui se trouvait liée à la sous-unité 60 S, se détache, se lie à l'extrémité 3' de l'ARNm qui code la céruloplasmine et, ce faisant, bloque la traduction de la protéine. Il est à remarquer que la protéosynthèse globale, estimée par l'incorporation de méthionine-35S, n'est pas significativement affectée par le processus.
L'unité Svedberg ( S) reflète la vitesse de sédimentation d'un composant cellulaire en solution sous l'effet de la force de gravité. Ce coefficient de sédimentation est dépendant aussi bien du poids moléculaire que de la structure tridimensionnelle du composant. Par exemple, la grande sous-unité du ribosome sédimente à une vitesse de 60 unités (60 S) et la petite à 40 S, cependant que le ribosome entier sédimente à 80 S.
Par définition, la constante de sédimentation S, est la vitesse de sédimentation par unité d'accélération (force g).
On l'écrit 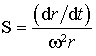 .
.
Comme cette constante est faible, on utilise, comme unité, le Svedberg (un Svedberg = 10-13 seconde).