Elongation de la chaîne peptidique
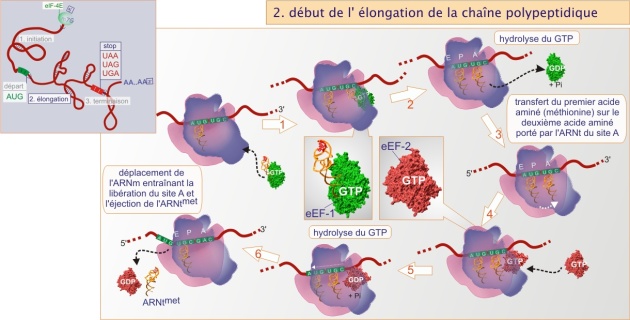
L'élongation est le processus au cours duquel les acides aminés s'associent un à un pour former une chaîne polypeptidique. Chaque acide aminé, lié à son ARNt qui porte un anticodon spécifique, est appelé à rejoindre la chaîne en élongation par la reconnaissance de son codon situé sur l'ARNm. Après fixation de l'ARNtMet (sur « le site P ») et l'association de la grande sous-unité à la petite, le deuxième codon pourra lier son ARNt - acide aminé (sur « le site A »), cette fois lié au facteur d'élongation eEF–1, lui-même associé au GTP. Si l'appariement codon - anticodon est suffisamment fort, l'hydrolyse de GTP est déclenchée, suivie par la dissociation d'eEF–1, qui à son tour déclenche la liaison entre la méthionine et le deuxième acide aminé. A l'inverse, si l'appariement n'est pas fort, l'ARNt quitte le site sans que le GTP puisse être hydrolysé et donc le lien entre les acides aminés n'est pas réalisé. En conclusion, le processus s'effectue par essais successifs de différents couples ARNt - acide aminé qui se présentent de façon aléatoire. Seule une forte reconnaissance codon - anticodon autorise la liaison peptidique. Cette sélection rigoureuse de l'ARNt, qui garantit la traduction fidèle du message, est connue sous l'appellation « proofreading ». L'ARNt qui portait la méthionine, associée maintenant au deuxième acide aminé, est chassé de son site au cours d'une opération menée par un deuxième facteur d'élongation, eEF2, et qui s'effectue grâce à l'hydrolyse de GTP. Cette opération s'accompagne d'un déplacement relatif de l' ARNm et du ribosome, appelé translocation. L'ensemble du processus se répète d'une façon systématique pour chaque codon suivant jusqu'au codon de terminaison.
Rappel :